Le graphène expliqué ( 1ère partie) , par Pr Marc Henry
De : https://marchenry.org/2021/12/15/56-le-graphene-et-ses-derives/
56•Le graphène et ses dérivés
Épisode 56 Covid-19, décembre 2021. Vice et vertu sont parents comme diamant et charbon…
Karl Kraus
Préambule
Comme promis, les prochaines chroniques vont être consacrées au graphène. Il circule, en effet, beaucoup d’informations alarmantes au sujet de cette substance sur internet. Qu’en est-il exactement ? Tout d’abord, j’aime autant vous prévenir tout de suite. Cette chronique va avoir des aspects techniques qui peuvent rebuter certains. C’est, hélas, le prix à payer pour avoir un avis objectif sur la question. Objectif signifie que l’on s’en réfère à la science et uniquement à la science pour se faire une opinion. De ce fait, les considérations idéologiques, politiques ou économiques sont exclues de mon analyse. Car, ces considérations sont de nature subjectives. Et, donc, soumises à un jugement personnel, plus ou moins biaisé par son histoire personnelle. La science, elle, ignore tout des aspects personnels. Elle est par nature impersonnelle. D’où son caractère inhumain et objectif qui se manifeste avec une virulence extrême de nos jours.
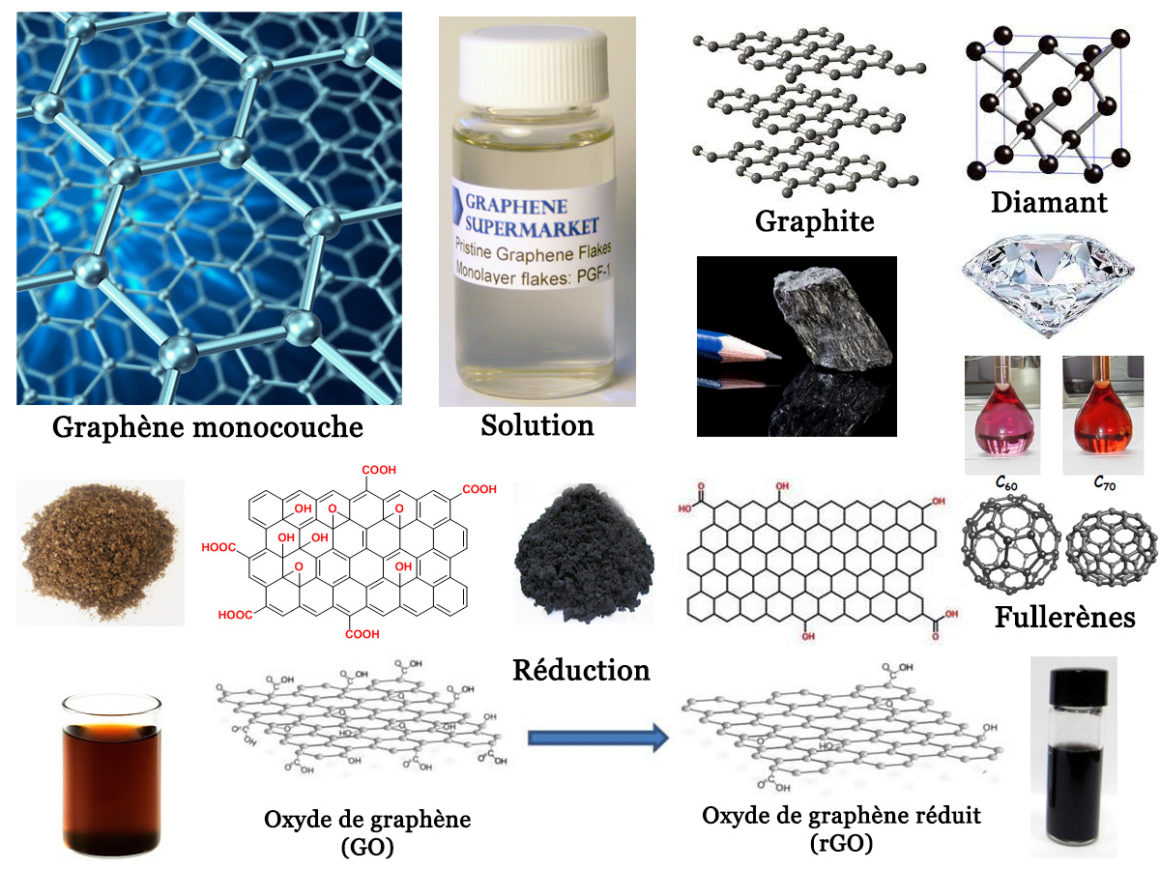
Comme je l’explique dans mes formations, la première chose à faire est d’avoir en tête une chronologie précise. Cette chronologie va nous servir à ancrer la connaissance distillée dans le présent. Un tel ancrage est de fait indispensable pour ne pas parler dans le vague. Le graphène est donc un sujet en relation avec le sixième élément du tableau périodique de Mendeleev : le carbone. Si l’on rajoute le premier élément (l’hydrogène) et le huitième élément (l’oxygène) on obtient deux substances dérivées : l’oxyde de graphène (GO) et l’oxyde de graphène réduit (rGO). Le terme « hydroxyde de graphène » (HG) souvent cité ces derniers jours ne correspond à rien de tangible sur le plan chimique. C’est un terme vague qui pourrait à la rigueur faire référence de manière indifférente au GO ou au rGO.
Le carbone graphite
Rappelons maintenant la chronologie de la substance carbone. Le graphite est une substance solide facilement clivable, de couleur noire, qui fond à 3652°C et se vaporise à 4827°C. Elle a été découverte en 1564 dans le Cumberland en Grande-Bretagne. Elle a permis l’invention des crayons de plombagine. Ces crayons ont été introduits en France sous le règne de Louis XIII. Or, par définition, un crayon sert à écrire. Le nom « graphite » dérive donc du verbe grec « γράφειν » (gráphein) qui signifie « écrire ». La densité du graphite est de 2,25 g·cm-3, contre 1 g·cm-3 pour l’eau liquide.
Le graphite présente une conductivité électrique anisotrope. Elle vaut 25 000 S·m-1 dans un plan et 25 S·m-1 dans la direction perpendiculaire au plan. Par comparaison, la conductivité électrique de l’eau de mer vaut seulement 5 S·m-1. Le graphite est de ce fait un bon conducteur du courant électrique. D’où sa couleur noire et brillante (voir l’image associée à la chronique). Ceci permet de l’employer pour faire des électrodes non métalliques. Son affinité pour le fer explique son emploi au XVIIIᵉ siècle dans la fonte des canons. Le fait que le graphite se clive facilement en feuillets (exfoliation) fait qu’on l’emploie comme lubrifiant dans l’industrie automobile. Son très haut point de fusion explique son omniprésence dans l’industrie nucléaire. En 2016, la production de graphite annuelle dans le monde s’élevait à 2,45 millions de tonnes.
Le carbone diamant
Le graphite est ce que l’on appelle une forme allotropique de l’élément carbone. L’autre forme allotropique s’appelle le diamant. L’histoire des diamants commence en Inde il y a plus de 4 000 ans. Les diamants servaient alors à orner des objets religieux. C’est vers 1330 que Venise commença à développer le polissage des facettes des diamants. La technique se propagea ensuite rapidement à toute l’Europe. Le mot diamant provient du grec ancien ἀδάμας (adámas) qui signifie « dur ». Ce terme fut ensuite traduit par « diamas ». Le diamant est beaucoup plus dense que le graphite : ρ = 3,52 g·cm-3. Contrairement au graphite, c’est un excellent isolant électrique.
Sa production mondiale en 2005 était de 35,1 tonnes par an. Le diamant est donc beaucoup plus rare que le graphite. Sa parfaite transparence, son indice de réfraction très élevé et sa très grande dureté explique son omniprésence en bijouterie. Il faudra attendre 1779 pour que ces deux substances, graphite et diamant, que tout oppose, soient reconnues comme deux formes d’un même élément chimique : le carbone.
Les fullerènes et les nanotubes de carbone
Jusqu’en 1985, on pense que le carbone n’existe que sous deux formes : graphite et diamant. Mais, le 4 septembre 1985, on découvre après vaporisation du graphite par ablation laser le fullerène C60. Puis, d’infimes quantités de fullerènes sont observés, sous la forme de molécules C60, C70, C76 et C84. Ces formes sont produites dans la nature, dans la suie lors des combustions et dans les éclairs à travers l’atmosphère.
En 1991, on découvre les nanotubes de carbone, de très petites dimensions, ayant une ou plusieurs parois. Ces nanotubes sont en fait des feuillets de graphite enroulés sur eux-mêmes comme des feuilles de papier à cigarettes. Le prix Nobel de chimie consacrant la découverte des fullerènes sera attribué à Harold Kroto, Robert Curl et Richard Smalley en 1996. Puis, en 1997, les fullerènes furent trouvés dans un minéral connu sous le nom de shungite dans la République russe de Carélie. La présence des fullerènes C60 et C70 dans l’espace interstellaire est mise en évidence en 2010 par spectroscopie infrarouge.
Entrée en scène du graphène
Le graphène ou graphite exfolié, apparaît en 2004. En effet, le graphite est composé de feuillets cristallins d’atomes de carbone formant une structure en nid d’abeilles de symétrie hexagonale (voir image). Ces feuillets sont empilés les uns sur les autres, mais peuvent être exfoliés, avec du ruban adhésif, ou bien au moyen d’ultrasons. Or, de telles techniques, ne fournissent qu’une quantité infime de matière. D’où des prix initialement astronomiques de plusieurs milliards de dollars pour 1 gramme de graphène monocouche. Mais, en 2008, on découvre que le graphène peut être obtenu par dépôt chimique en phase vapeur (CVD).
On dépose pour cela du méthane sur une surface de cuivre et on le force à réagir avec ce dernier pour libérer de l’hydrogène. Ceci laisse ainsi un dépôt d’une monocouche de graphène sur la surface de cuivre. On dépose ensuite un revêtement de poly-méthyle-méthacrylate (PMMA) sur la surface qui est trempée dans l’eau afin de servir d’électrode. Par électrolyse de l’eau, on forme ensuite des bulles d’hydrogène qui vont permettre de décoller le graphène de la surface. On le récupère ainsi en solution dans l’eau. On peut ainsi le manipuler grâce à la couche de polymère PMMA. Par dissolution de cette couche, on récupère le feuillet monocouche de carbone pur pour des applications diverses et variées.
Propriétés du graphène
La découverte du graphène en 2004 permettra à André Geim et Konstantin Novoselov d’obtenir le prix Nobel de physique en 2010. Structuralement parlant, le graphène se définit comme une feuille de carbone d’épaisseur monoatomique à structure hexagonale. On parle aussi de graphite monocouche. Il est souvent qualifié de matériau « miracle », compte tenu de ses propriétés uniques. Il s’agit du matériau le plus fin (0,34 nanomètre d’épaisseur) et le plus léger connu à ce jour (0,77 mg·m-2).
Ses propriétés intéressantes comprennent une forte conductivité électrique (108 S·m-1), une forte conductivité thermique (5000 W·m-1·K-1) ainsi qu’une résistance mécanique élevée (~40 N·m-1). Son module de Young est de 1 TPa, pour une transmittance optique de 97,7% (solutions transparentes). Il présente aussi une très grande surface spécifique (~2600 m2·g-1). Avec les techniques modernes de production, on peut acheter dans le commerce pour $55, des flocons de monocouche de graphène vierge (50 ml) dispersés dans l’éthanol à la concentration 1 mg·L-1. Le teneur en carbone est garantie à 99,99% sans tensioactifs avec des tailles moyennes voisines de 550 nm (150-3 000 nm).
Oxyde de graphène (GO)
Toutefois, la synthèse du graphène reste difficile, surtout à grande échelle. C’est pour cette raison que sa découverte a donné naissance à ses dérivés tels que l’oxyde de graphène (GO) et l’oxyde de graphène réduit (rGO). La production de ces matériaux est, en effet, relativement plus facile à grande échelle. L’oxyde de graphène (GO) est considéré comme la forme oxydée du graphène. En fait, la découverte de l’oxyde de graphène est bien antérieure à celle du graphène. En 1859, le GO a été synthétisé pour la première fois par oxydation et exfoliation du graphite. Cependant, jusqu’à la découverte du graphène, l’oxyde de graphène est resté plutôt insignifiant.
C’est après la découverte du graphène que l’oxyde de graphène a également attiré l’attention comme moyen possible d’obtenir du graphène. Depuis ce moment, les études sur l’oxyde de graphène se sont accélérées et le GO lui-même a trouvé différentes applications. On obtient le GO par traitement du graphite au moyen d’oxydants forts comme l’acide sulfurique H2SO4 ou le permanganate de potassium KMnO4. L’étape ultérieure d’exfoliation est réalisée par des méthodes de pelage mécanique telles que la sonication, la contrainte de cisaillement ou le dépôt chimique en phase vapeur (CVD).
Structure de l’oxyde de graphène
D’un point de vue chimique, la feuille de graphène monocouche du graphite est formée d’atomes de carbone engagés dans trois liaisons covalentes fortes. L’énergie de liaison vaut ici 450 zepto-joules (1 zJ = 10-21 J). Par comparaison, l’énergie de liaison entre deux feuilles monocouches n’est que de 56 zJ, valeur typique d’une liaison hydrogène forte. Après oxydation, certains atomes de carbone forment 4 liaisons covalentes au lieu des trois initialement présentes. Ces atomes acquièrent alors plusieurs groupes fonctionnels différents contenant de l’oxygène, tels que des groupes carboxyles (-COOH), hydroxyles (-OH) ou époxy (>O). Par conséquent, le GO oxydé à 50-55% peut être dispersé dans l’eau et dans plusieurs solvants polaires. On obtient ainsi des solutions de couleur brune.
Une dispersion aqueuse de GO peut ainsi être utilisée comme lubrifiant pour réduire la friction sur les surfaces métalliques. L’oxydation des couches de graphite augmente l’espacement interplanaire de la structure graphitique, ce qui facilite l’exfoliation. Alors qu’il existe une seule forme de graphène, le GO existe sous de multiples formes, selon le taux d’oxydation et la taille du graphite utilisé comme matériau de départ. D’où des propriétés modulables à l’infini, pour un même motif de base. On notera que contrairement au graphène, le GO est un isolant électrique, de couleur brune à l’état solide.
L’oxyde de graphène réduit (rGO)
La réduction de l’oxyde de graphène (rGO) est considérée comme une voie intéressante pour obtenir un comportement semblable à celui du graphène vierge. Des méthodes de réduction chimiques, thermiques ou photo-thermiques sont utilisées pour obtenir du rGO. Cependant, le rGO ne peut pas atteindre la structure de graphène vierge. Il reste, en effet, après réduction, toujours des défauts ou des impuretés. Les études montrent que les méthodes de réduction thermique sont avantageuses en comparaison aux méthodes de réduction chimique. Non seulement un niveau de réduction plus faible est atteint par les méthodes de réduction chimique, mais les agents réducteurs utilisés dans ces méthodes sont également très toxiques. Les méthodes de réduction thermique ont le dessus à cause de leur niveau élevé de réduction et de leur processus relativement respectueux de l’environnement.
Le rapport carbone/oxygène du produit obtenu est une caractéristique importante. Plus le rapport C/O est élevé, plus les propriétés du rGO sont proches de celles du graphène vierge. Contrairement au GO, le rGO est un conducteur de l’électricité et peut donc être employé comme matériau d’électrode. D’où sa couleur noire qui le distingue très nettement du graphène transparent ou du GO de couleur brune. Nous n’irons pas plus loin pour cette première partie. Parce qu’il va vous falloir absorber toutes ces connaissances pour comprendre les autres chroniques. Dans une deuxième partie, j’expliquerais quelles sont les applications de ces nouveaux matériaux apparus dès 2004


Commentaires
Enregistrer un commentaire