Changement de classe IgG4 et aortite liée aux immunoglobulines G4 - Partie IV : Une étude approfondie des mécanismes
De : https://doorlesscarp953-substack-com.
Traduction automatique NON RELUE
Immunologie - 8 octobre 2024 - par DoorlessCarp
Tous les extraits utilisés dans l'article suivant sont destinés à des fins de recherche et d'éducation non commerciales uniquement et peuvent être soumis aux droits d'auteur de leurs propriétaires respectifs.
Contenu
Introduction
Dans la première partie, j'ai examiné 3 rapports de cas d'IgG4-RA et de myocardite ; la deuxième partie a examiné 7 rapports de cas d'autres maladies associées au changement de classe d'IgG4 après la vaccination contre la COVID-19 ; et la troisième partie a commencé à examiner les mécanismes derrière l'IgG4-RA, avec une plongée en profondeur dans l'amorçage des macrophages via les récepteurs à chaîne fragmentée (FcR)
Dans la quatrième partie, nous verrons si les derniers vaccins ont résolu le problème, nous étudierons les mécanismes d’inhibition, la polarisation des macrophages, les interactions avec les récepteurs Fc et un microARN qui apparaît sans cesse dans les cancers et les maladies auto-immunes aussi régulièrement que l’on trouve un politicien à la solde des grandes sociétés pharmaceutiques.
Discussion
Un problème récurrent
La MHRA a approuvé un vaccin à ARNm monovalent spécifique Omicron XBB.1.5 à la fin de 2023. Malheureusement, une étude réalisée l'année suivante par Jain et al. (2024) a montré qu'il était tout aussi puissant pour induire une recombinaison de commutation de classe (CSR) en IgG4 que les vaccins à ARNm précédents.1
Le mensonge présenté (c'est moi qui souligne tout au long) :
Un vaccin COVID-19 adapté de Moderna (Spikevax) qui cible la sous-variante Omicron XBB 1.5, a été autorisé aujourd'hui par l'Agence de réglementation des médicaments et des produits de santé (MHRA) après avoir jugé qu'il répondait aux normes de sécurité, de qualité et d'efficacité du régulateur britannique.
Le vaccin a été approuvé pour une utilisation chez les personnes à partir de 6 mois.
Le vaccin adapté fonctionne de la même manière que le vaccin original en amenant le système immunitaire (les défenses naturelles de l'organisme) à produire des anticorps et des cellules sanguines qui agissent contre le virus, offrant ainsi une protection contre la COVID-19. Tous les vaccins adaptés contre la COVID-19 approuvés contribuent à améliorer la protection obtenue grâce aux doses précédentes du vaccin et à offrir une protection à plus long terme contre les formes graves de la maladie.
De : « La MHRA approuve le vaccin COVID-19 adapté de Moderna (Spikevax) qui cible Omicron XBB.1.5 » (15 septembre 2023)
La réalité est que même les nouveaux vaccins monovalents variants induisent toujours une recombinaison de changement de classe (CSR) , avec des titres élevés d'IgG4.
Extraits clés de « Le rappel monovalent XBB.1.5 améliore la liaison et la neutralisation des anticorps contre les variants émergents du SARS-CoV-2 Omicron »2par Jain et al. (5 février 2024) :
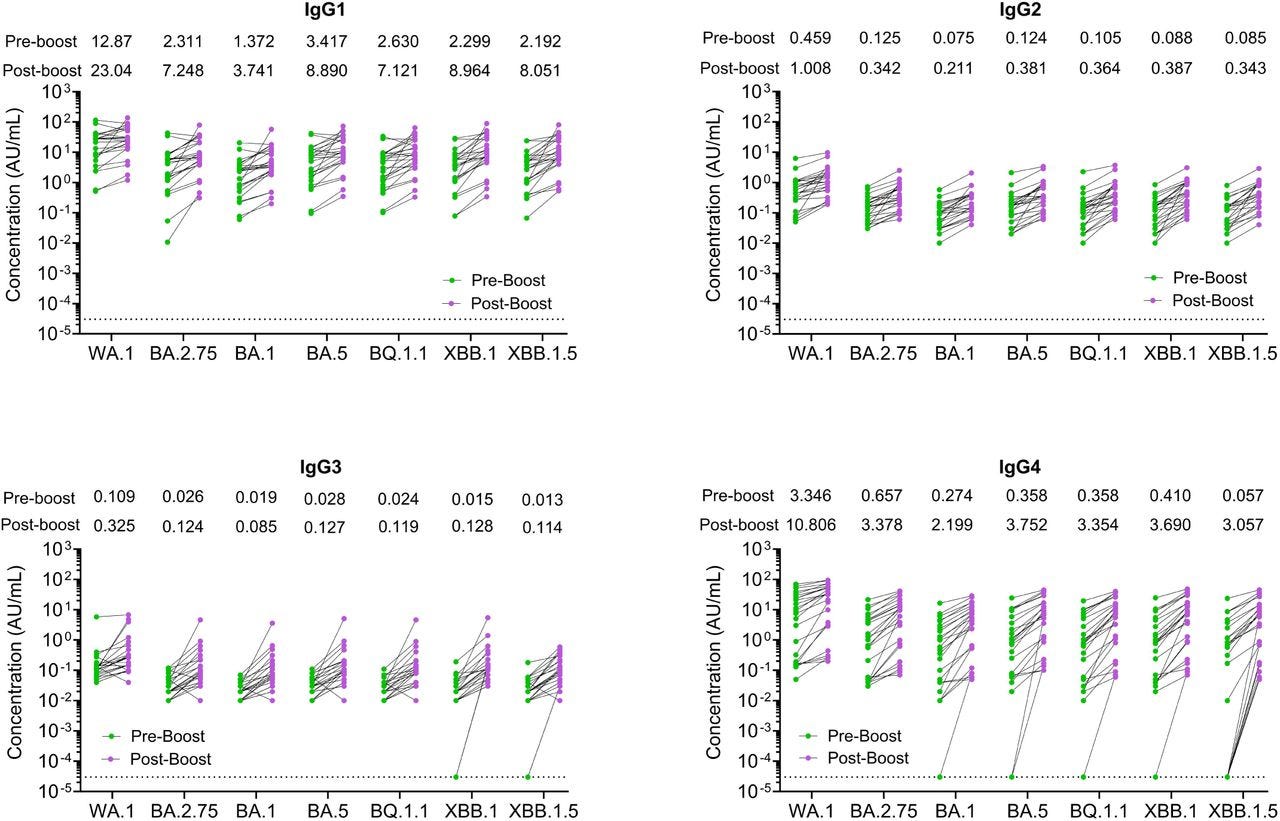
… Après le rappel monovalent XBB.1.5, la liaison des IgG1, IgG2, IgG3 et IgG4 à la protéine de pointe WA1 a augmenté respectivement de 1,8 fois, 2,4 fois, 3 fois et 3,2 fois ( Fig. 3 ).
Extrait de la « Figure 3. Liaison de la sous-classe d'IgG du SRAS-CoV-2 aux variants du SRAS-CoV-2 après la dose de rappel moovalente XBB.1.5. Les réponses des sous-classes d'anticorps IgG contre les protéines de pointe du SRAS-CoV-2 ont été mesurées par un immuno-essai multiplex électro-chimiluminescent à l'aide de la plateforme MSD et rapportées en unités arbitraires par ml (AU/mL) normalisées par une courbe standard utilisant un anticorps monoclonal. Sont indiqués les titres d'anticorps des sous-classes d'IgG se liant aux pointes contre les sous-variantes WA1 et Omicron pour les 24 participants avant (symboles verts) et après (symboles roses) la réception de la vaccination de rappel XBB.1.5. La ligne pointillée dans les tests de liaison aux pointes représente la limite de détection. » Source : https://www.biorxiv.org/content/10.1101/2024.02.03.578771v1.full … Des recherches supplémentaires sont donc nécessaires pour évaluer les mécanismes de changement préférentiel de classe IgG4 induit par le vaccin à ARNm monovalent XBB.1.5, ce qui est pertinent pour la conception de futures vaccinations de rappel saisonnières contre le SRAS-CoV-2.
Il a été émis l’hypothèse que l’émergence de cellules B à mémoire à commutation d’isotype est compatible avec une réponse du centre germinatif (GC) plus robuste et plus durable induite par les vaccins à base d’ARNm 25 .
Ces résultats contrastent avec l'induction prédominante d'IgG1 et d'IgG3 après des infections naturelles par le SARS-CoV-2 26 . L'IgG4 a une activité fonctionnelle limitée en raison de caractéristiques structurelles qui altèrent sa liaison aux récepteurs C1q et Fc qui assurent l'opsonisation et la cytotoxicité cellulaire dépendante des anticorps 27 .
Ces caractéristiques font probablement de l'IgG4 un anticorps bloquant ou suppresseur 28 . Des recherches plus poussées sont donc nécessaires pour définir le rôle de l'IgG4 anti-spike induit par le vaccin de rappel monovalent XBB.1.5 dans la protection ou son impact sur la réponse aux futures vaccinations de rappel.
Qu'en est-il des injections bivalentes ?
Si vous espériez que les nouveaux produits d'ARNm conçus pourraient inverser la CSR IgG4, ce n'est malheureusement pas une bonne nouvelle.
Un grand merci au Dr Alberto Rubio-Casillas pour avoir partagé une étude très récente examinant précisément ce problème.
En bref, leurs recherches semblent confirmer que les personnes âgées présentent un risque accru , et non diminué, de développer une RSC, comme les auteurs le pensaient peut-être au départ.
Extraits clés de « La vaccination répétée à l’ARNm contre la COVID-19 entraîne un changement de classe IgG4 et une diminution de l’activation des cellules NK par les anticorps spécifiques de S1 chez les personnes âgées »3par Gelderloos et al. (14 septembre 2024) :
Résultats
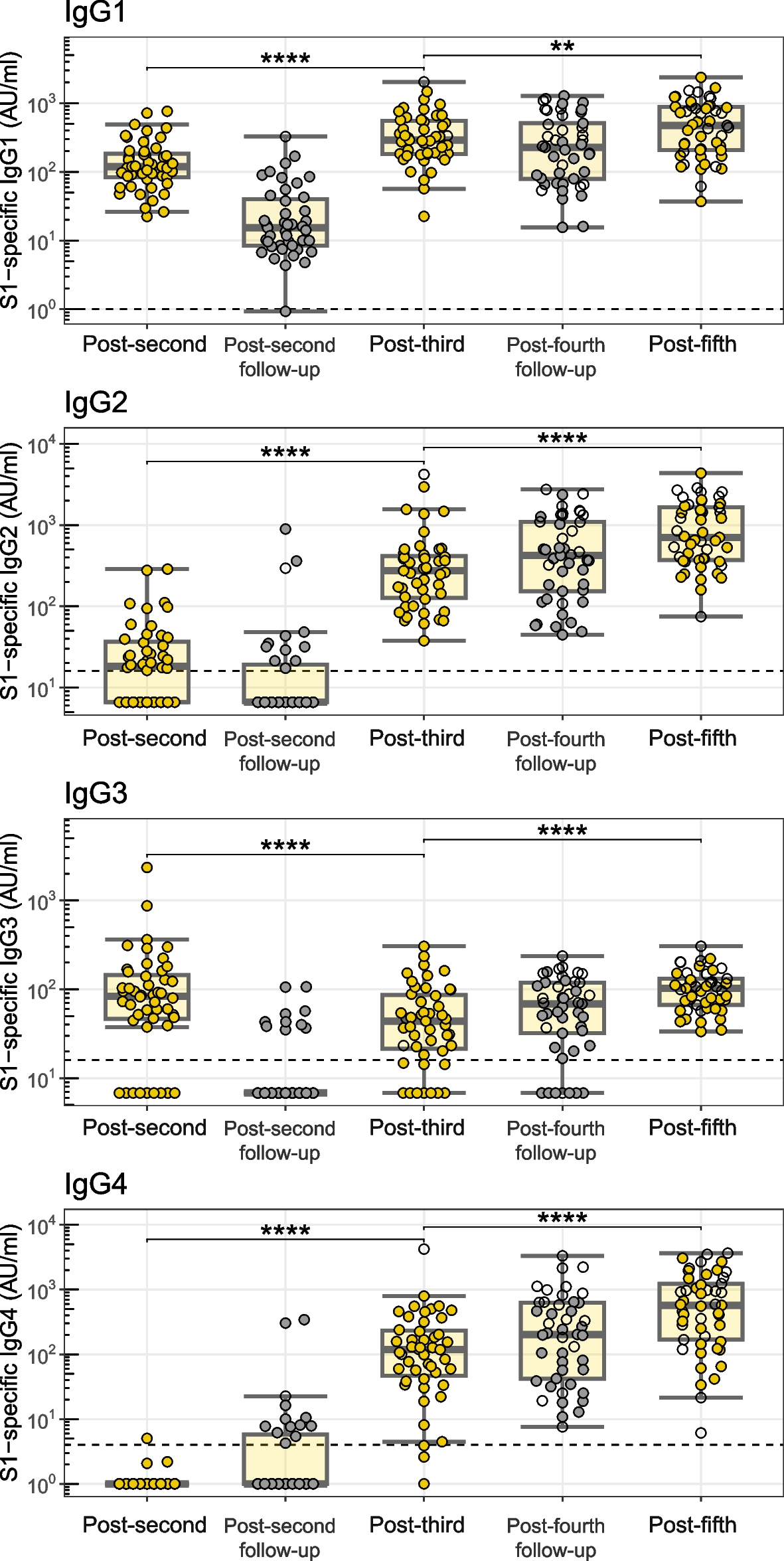
Les concentrations de la sous-classe d'IgG spécifique de Spike S1 (exprimées en unités arbitraires par ml), l'activation des cellules NK dépendante des anticorps, le dépôt de complément et la phagocytose des monocytes ont été quantifiés dans le sérum des adultes plus âgés (n = 38-50, 65-83 ans) un mois après la deuxième, la troisième et la cinquième vaccination.
La distribution des sous-classes dans le sérum a été comparée à celle des adultes plus jeunes (n = 64, 18-47 ans) un mois après la deuxième et la troisième vaccination.
En fait, la situation s’aggrave avec l’âge, malgré l’apparition de l’immunosénescence et l’exposition tout au long de la vie à d’autres antigènes, tels que les coronavirus à réactivité croisée :
Par rapport aux individus plus jeunes, les adultes plus âgés ont montré des niveaux accrus d’IgG2 et d’IgG4 un mois après la troisième vaccination (possiblement liée à des facteurs autres que l’âge) et une augmentation supplémentaire après une cinquième dose.
Ce n'est pas non plus un simple exercice sur papier. Plus vous avez d'anticorps IgG4 par rapport aux IgG1, moins vos cellules tueuses naturelles sont activées par le SARS-CoV-2 et plus votre système complémentaire est altéré :
La capacité des anticorps sériques spécifiques à favoriser l'activation des cellules NK et le dépôt du complément par rapport aux concentrations totales d'IgG spécifiques de S1 a diminué après une vaccination répétée. Cette diminution est associée à une augmentation du rapport IgG4/IgG1.
Conclusions
En conclusion, ces résultats montrent que, comme les individus plus jeunes, les adultes plus âgés produisent des anticorps avec une capacité fonctionnelle réduite lors de vaccinations répétées à ARNm contre la COVID-19.
La raison de nos revues et de ces sous-piles, ainsi que nos recommandations pour davantage de recherches et d'évaluations cliniques :
Des recherches supplémentaires sont nécessaires pour mieux comprendre les mécanismes sous-jacents à ces réponses et leurs implications potentielles sur l’efficacité des vaccins. Ces connaissances sont essentielles pour la conception future de stratégies de vaccination optimales pour la population vieillissante.
… Ensuite, nous avons évalué les concentrations spécifiques de la protéine S1 du pic SARS-CoV-2 d’IgG1, IgG2, IgG3 et IgG4 à l’aide d’un immuno-essai multiplex basé sur des billes (Fig. 2 ).
Tout cela a tout d’un cauchemar de santé publique, surtout si, comme les données semblent le suggérer, la réponse immunitaire ne revient pas à la normale avec le temps :
Alors que seule une (faible) proportion de participants présente des niveaux détectables d’IgG2 et d’IgG4 après la deuxième vaccination (58 % et 2,1 %, respectivement), pratiquement tous les participants présentent des niveaux détectables de ces sous-classes après la troisième vaccination (100 % et 94 %, respectivement).
Encore une fois, si vous avez été infecté avant la vaccination, cela semble être une protection. Ma seule inquiétude est que, selon les anecdotes, beaucoup d'entre nous ont été infectés fin 2019/20 avant la vaccination. Deviez-vous être infecté à proximité du moment de la vaccination pour que cela empêche la CSR ?
Malgré la taille très limitée du groupe (n = 4), nous avons observé que les personnes âgées exclues de l'analyse globale parce qu'elles avaient été infectées avant de recevoir leur première vaccination contre la COVID-19 présentaient des niveaux remarquablement réduits d'IgG4 et d'IgG2 après une vaccination répétée (Fig. 3 et Figure supplémentaire S2).
Nous n’avons pas observé de différences notables dans les concentrations de sous-classes d’IgG entre les participants féminins et masculins (figure supplémentaire S3).
Étant donné que nous avons observé une induction frappante d’anticorps IgG4 spécifiques de S1 chez les personnes âgées, nous nous sommes demandé si cela pouvait être associé à des différences dans la capacité fonctionnelle des anticorps par rapport à la concentration totale d’IgG spécifiques de S1.
Oui ! Plus d'Ac IgG4 = moins d'Ac anti-Spike fonctionnels :
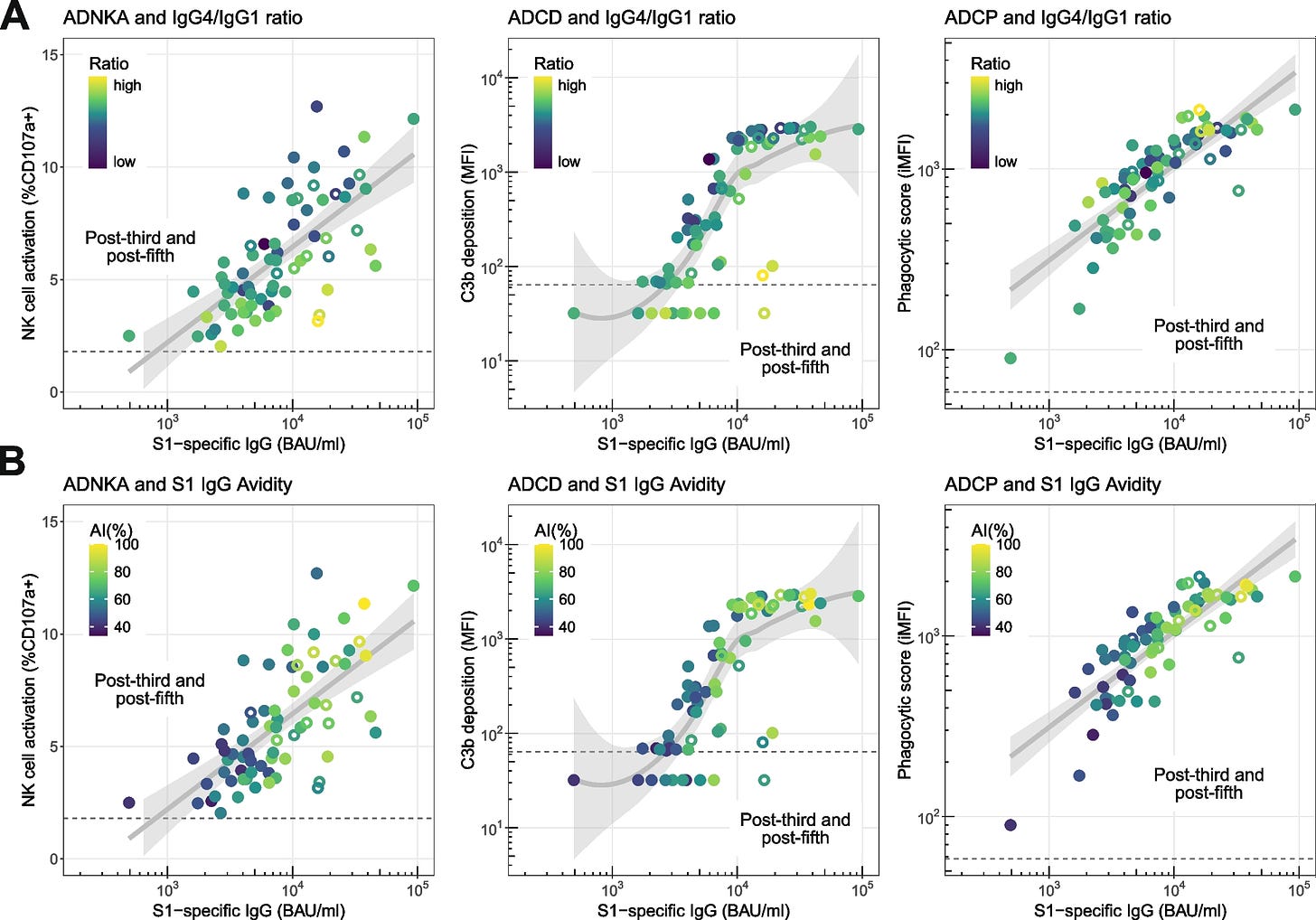
Nos données suggèrent que, conformément aux propriétés fonctionnelles connues de l'IgG4, des rapports IgG4/IgG1 spécifiques à S1 plus élevés - c'est-à-dire des concentrations relativement plus élevées d'IgG4 - s'associent en effet à une capacité relative plus faible à activer les cellules NK et à déposer du complément (Fig. 6 A).
À partir de ces graphiques, il est évident que les points de données les plus sombres (rapports IgG4/IgG1 inférieurs) ont tendance à se localiser au-dessus de la ligne représentant la corrélation moyenne entre la fonctionnalité et la concentration, tandis que les points de données plus clairs (rapports IgG4/IgG1 plus élevés) ont tendance à se situer en dessous de cette ligne, en particulier pour ADNKA.
La capacité de phagocytose spécifique de S1 par rapport à la concentration totale d'IgG n'était pas clairement associée au rapport IgG4/IgG1.
ADNKA : activation des cellules NK dépendante des anticorps (colonne de gauche).
Interprétation : Un rapport IgG4/IgG1 plus élevé, en jaune, est associé à une activation nettement réduite des cellules tueuses naturelles :
Auparavant, nous avons également observé une diminution de l’activation des cellules NK dépendante des anticorps par rapport à la concentration d’anticorps au fil du temps après une infection primaire par le SARS-CoV-2 chez les enfants et les adultes [ 33 ].
Bien que nous n'ayons pas évalué les niveaux de sous-classe dans cette étude, le déclin dans ce contexte était probablement dû à la diminution des anticorps IgG3 spécifiques du virus, qui sont connus pour être des médiateurs supérieurs de l'ADNKA mais qui ont une demi-vie courte par rapport aux autres sous-classes [ 19 ].
Vous ne pouvez pas blâmer le virus pour cela :
De plus, il est très peu probable que des quantités significatives d’IgG4 aient été produites en réponse à une infection virale primaire.
En revanche, dans l'étude actuelle, la diminution de l'ADNKA par rapport à la concentration en anticorps ne semble pas liée à la présence d'IgG3, car les niveaux médians de cette sous-classe augmentent en réalité entre la troisième et la cinquième vaccination. Le rôle potentiel de l'IgG4 dans la diminution de l'ADNKA par rapport à la concentration en anticorps est conforme aux caractéristiques fonctionnelles connues de l'IgG4 [18, 19].
Je réfuterais cette conclusion, car les vaccins n’ont jamais été efficaces pour prévenir l’infection ou la transmission en premier lieu, et les infections percées sont un phénomène courant :
À l’heure actuelle, on ne sait pas encore dans quelle mesure (le cas échéant) l’apparition d’IgG4 spécifiques du virus affectera l’efficacité du vaccin, qui jusqu’à présent semble suffisante [ 41 , 42 ].
Les résultats de leurs propres études confirment également que cela est absurde :
Français Comme prévu sur la base de travaux antérieurs, notre étude confirme que des niveaux accrus d'IgG4 sont associés à une fonctionnalité effectrice médiée par Fc réduite [ 6 , 19 ]. Considérant qu'en plus de la neutralisation du virus (qui n'est pas affectée par l'induction d'IgG4), il existe de plus en plus de preuves suggérant que ces fonctions effectrices médiées par Fc contribuent à la protection immunologique contre la maladie [ 20 , 21 , 22 , 23 , 24 , 25 , 26 , 27 , 28 , 43 ], on pourrait s'attendre à ce que l'induction d'IgG4 ne soit pas bénéfique pour l'efficacité du vaccin.
Ils s’accrochent à des brins de paille. Des réponses immunitaires altérées à un virus chimérique avec des inserts VIH sont la dernière chose que l’on souhaite. Je pense que cela ne ferait rien non plus pour empêcher la tempête de cytokines, car elle affecte les individus ayant une charge virale élevée, peut-être en raison de cellules T régulatrices COVID-19 hyperactives (Tregs) , qui peuvent altérer les réponses antivirales4:
Alternativement, l'IgG4 pourrait jouer un rôle bénéfique dans la réduction du potentiel inflammatoire des niveaux d'IgG en augmentation continue lors de vaccinations répétées [ 18 ].
Je ne peux pas être en désaccord avec cela :
Quoi qu’il en soit, il sera impératif de suivre cette évolution dans le cadre d’études de population plus vastes dans lesquelles les infections et les symptômes perpétrés seront dûment enregistrés, en particulier à la lumière d’éventuelles vaccinations de rappel supplémentaires.
En conclusion, nous avons montré que les adultes plus âgés, comme les individus plus jeunes, sont enclins à développer des réponses IgG4 lors de vaccinations répétées à l'ARNm contre la COVID-19 et que des niveaux accrus d'IgG4 sont associés à une réduction relative de la fonctionnalité effectrice médiée par Fc.
Mécanismes d'inhibition
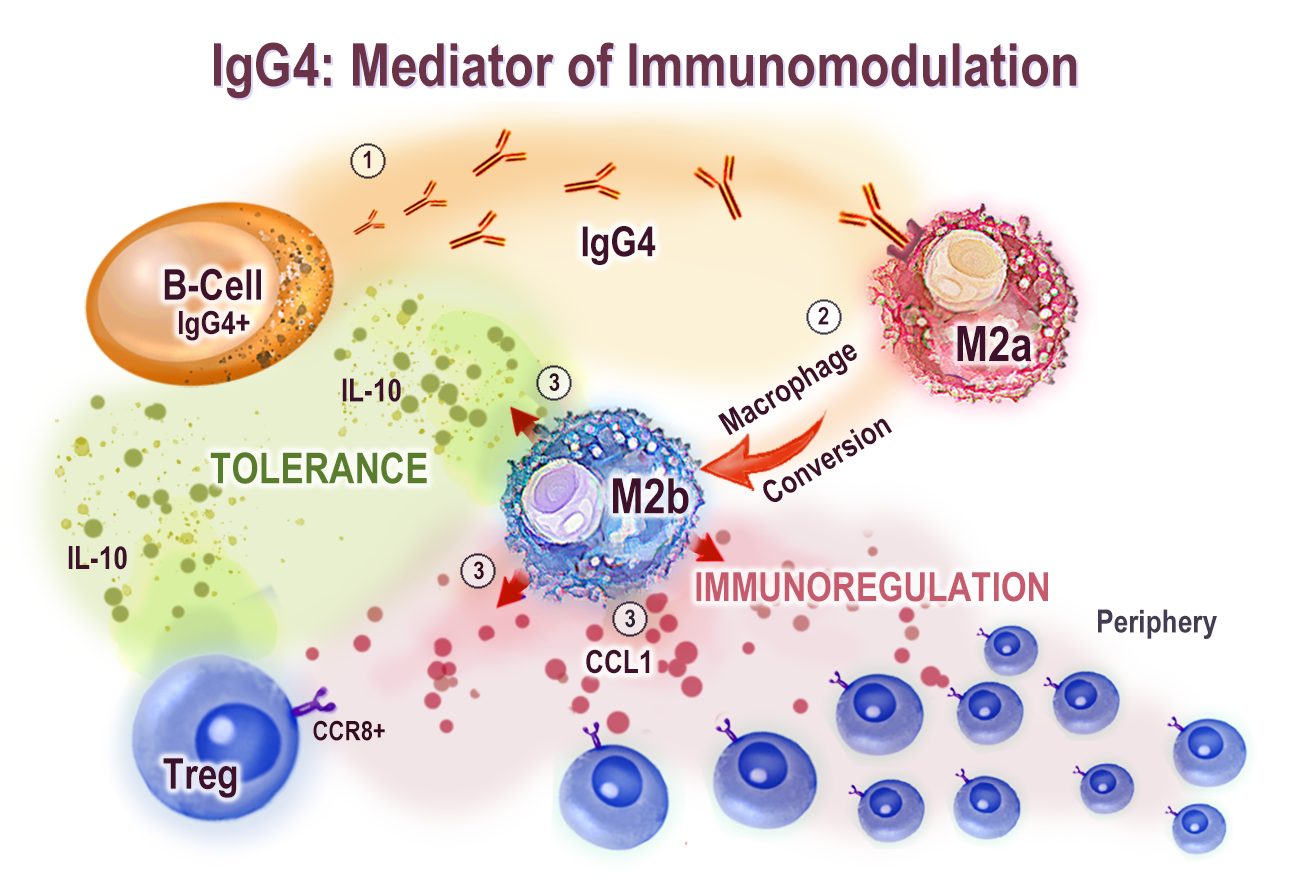
Une excellente introduction aux propriétés immunomodulatrices de l'IgG4 provient de « Le rôle de l'IgG4 dans le réglage fin de la tolérance dans l'allergie et le cancer à médiation IgE » (2020) par Bianchini et al.5:
Abstrait
Parmi les quatre sous-classes d'immunoglobulines G (IgG), l'IgG4 est la moins représentée dans le sérum d'un humain sain et est considérée comme un anticorps « étrange ». L'anticorps IgG4 possède des caractéristiques structurelles uniques qui affectent sa fonction biologique. Il s'agit notamment de la capacité à subir un échange de bras de fragment de liaison à l'antigène (Fab), à créer une liaison fragment cristallisable (Fc)-Fc avec d'autres IgG4 et d'autres anticorps de sous-classe IgG, à avoir un profil d'affinité unique pour les récepteurs Fc gamma (FcγR) et à ne pas se lier au composant C1q du complément.
L'ensemble de ces caractéristiques confirme le rôle anti-inflammatoire des IgG4, qui conduit à une tolérance immunitaire. Dans des conditions de stimulation antigénique chronique et d'inflammation de type Th2, les taux d'IgG4 tissulaires et sériques augmentent.
Cette revue cherche à mettre en évidence comment, dans l'immunothérapie allergénique, l'IgG4 peut conférer un rôle protecteur en tant qu'anticorps « bloquant » et protéger contre une exposition ultérieure aux allergènes, tandis que l'IgG4 peut conférer des fonctions immunomodulatrices pour soutenir la malignité.
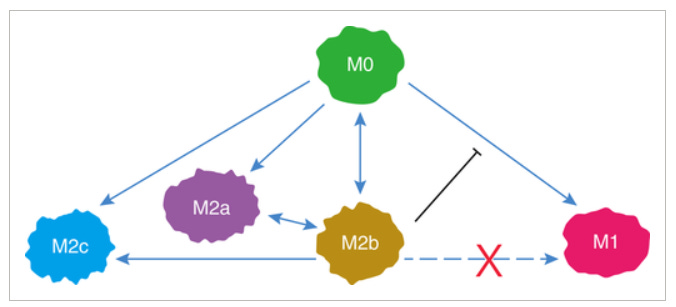
Alors que les conditions Th2 entraînent la polarisation des macrophages vers le sous-type M2a, la stimulation antigénique chronique entraîne le passage de la classe des cellules B à l'IgG4 pour soutenir davantage les changements phénotypiques des macrophages vers un état de type M2b.
Les macrophages de type M2b peuvent sécréter du ligand 1 de chimiokine (motif CC) (CCL1) et de l'interleukine-10 (IL-10) pour soutenir le recrutement cellulaire régulateur et pour façonner davantage un microenvironnement tolérogène. Ainsi, les IgG4 jouent un rôle à deux faces, favorable dans l'allergie mais néfaste dans le cancer.
Polarisation des macrophages vers M2b
Extrait de « Polarisation des macrophages M2b et ses rôles dans les maladies »6(2018) par Wang et al. :
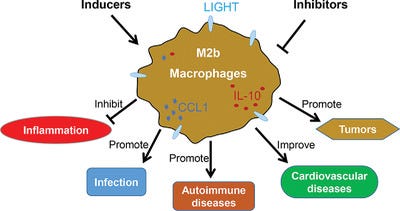
Les macrophages sont généralement divisés en deux sous-ensembles distincts : les macrophages classiquement activés (M1) et les macrophages alternativement activés (M2). M2b, un sous-type de macrophages M2, a attiré une attention croissante au cours de la dernière décennie en raison de ses puissants effets immuno-régulés et anti-inflammatoires .
Une grande variété de stimuli et de multiples facteurs modulent la polarisation des macrophages M2b in vitro et in vivo. Les macrophages M2b jouent à la fois un rôle protecteur et pathogène dans diverses maladies. La compréhension des mécanismes d'activation des macrophages M2b et de la modulation de leur polarisation pourrait ouvrir de grandes perspectives pour la conception de nouvelles stratégies thérapeutiques.
Les macrophages M2 peuvent être polarisés par plusieurs facteurs de stimulation, parmi lesquels les cytokines (IL-4, IL-10 et IL-13), les glucocorticoïdes, les complexes immuns (IC) et les LPS. Différents sous-types de macrophages M2 peuvent être induits par différents facteurs de stimulation.
Vous devez être très prudent lorsque vous utilisez des thérapies qui modifient la polarisation des macrophages :
En tant que sous-type M2, les macrophages M2b, également appelés macrophages régulateurs, peuvent être induits par exposition combinée aux agonistes IC et TLR ou par des agonistes IL-1R et exprimer des niveaux élevés de CCL1 et du membre 14 de la superfamille TNF (TNFSF14). 2 , 4 , 7 , 14 , 23 , 24
Ils peuvent également être pro-inflammatoires :
En plus des cytokines pro-inflammatoires (IL-1β, IL-6 et TNF-α), les cellules M2b expriment et sécrètent également des quantités substantielles de la cytokine anti-inflammatoire IL-10 et de faibles niveaux d'IL-12, qui est l'inverse fonctionnel des cellules M1. 2 , 4 , 24 Sur la base du profil d'expression des cytokines, des chimiokines et d'autres facteurs sécrétés, les macrophages M2b régulent l'ampleur et la profondeur de la réponse immunitaire et de la réaction inflammatoire. 2
… ou ils peuvent favoriser le cancer et les maladies infectieuses :
Dans le cancer et les maladies infectieuses, les macrophages M2b favorisent le développement des tumeurs et les infections parasitaires, bactériennes et fongiques en atténuant la réponse immunitaire et inflammatoire. 25 - 31
De plus, les macrophages M2b peuvent réduire les lésions de la moelle épinière (LME) et les lésions d’ischémie/reperfusion myocardique (IR) et contribuer à la guérison de ces lésions. 6 , 24 , 32
Malgré divers rôles importants dans de nombreuses maladies, les marqueurs moléculaires définis et spécifiques du macrophage M2b n'ont pas encore été unifiés et établis à ce jour.
Des comparaisons peuvent être faites entre l’IgG4-RD et le mal des radiations :
3.4 Modulation par rayonnement
L'exposition aiguë aux radiations peut provoquer des lésions mortelles des systèmes hématopoïétique et gastro-intestinal. 129 Après une radiothérapie corporelle totale de 5 à 9 Gy, les macrophages des ganglions lymphatiques mésentériques (GMM) se polarisent vers le phénotype M2b . 49 , 50
Ce sous-type de macrophages n'est pas converti en macrophages M1 en réponse à la stimulation par les antigènes d'E. faecalis et inhibe la conversion des macrophages de M0 résidents à M1.50
Une étude plus approfondie a montré que le miR-222, induit par une irradiation corporelle totale, réduit l’expression de GAS5, entraînant une augmentation des niveaux de CCL1 et une conversion des macrophages en M2b . 49
La suppression de CCL1 a inversé la polarisation M2b :
De plus, après traitement avec des oligodésoxynucléotides antisens CCL1 (CCL1-ODN, qui peuvent diminuer le niveau d'ARNm de CCL1), les macrophages M2b disparaissent dans les MLN des souris irradiées, et M1 est généré dans les MLN de ces souris suite à une stimulation par E. faecalis. 50 Cependant, on ne sait pas comment le rayonnement induit l'expression de miR-222.
De plus, certains rapports ont montré que la radiothérapie thoracique augmente les événements cardiovasculaires et le développement de l’athérosclérose chez les patients atteints de cancer. 11 , 130 , 131
Il est intéressant de noter que l’irradiation locale de 14 Gy chez les souris ApoE −/− entraîne un plus grand nombre de macrophages M1 et un plus petit nombre de macrophages M2 dans les lésions athéroscléreuses. 132 De plus, l’irradiation réduit la capacité phagocytaire des macrophages M2, contribuant probablement à l’augmentation des cellules apoptotiques et au déplacement de la polarisation des macrophages vers un phénotype M1 pro-inflammatoire in vitro. 132
Ces observations indiquent que, dans le cadre de différentes maladies, différentes doses de radiations ont des effets différents sur les macrophages dans différents tissus. En raison de l'application extensive de la radiothérapie chez les patients cancéreux, il sera important d'étudier l'effet des radiations sur le phénotype des macrophages afin d'améliorer l'efficacité de la radiothérapie dans des études ultérieures.
Ils peuvent contribuer au développement du lupus :
Les macrophages M2b jouent un rôle important dans les maladies inflammatoires, en particulier dans les maladies auto-immunes ou auto-inflammatoires. Des études ont montré que les macrophages M1 jouent un rôle inflammatoire important dans la pathogenèse du lupus érythémateux disséminé (LED), et que les macrophages M2b ont en fait un rôle direct dans l'apparition du LED.
Ils peuvent, comme ci-dessus, avoir un effet protecteur contre les maladies cardiovasculaires :
Dans les maladies myocardiques, notre étude récente a indiqué que les macrophages M2b (IL-10 + , LIGHT + , F4/80 + ) ont des effets cardioprotecteurs. 24 Nous avons induit une polarisation BMDM vers les macrophages M2b par exposition au LPS et à l'IC. Ensuite, nous avons transplanté des macrophages M2b dans la zone de lésion I/R myocardique et avons constaté que le taux de troponine cardiaque I sérique (cTnI), la zone d'infarctus et l'indice d'apoptose étaient diminués dans le groupe de macrophages M2b transplantés.
L'effet cardioprotecteur des macrophages M2b transplantés se produit via leur réduction de l'activation de la signalisation NF-κB et de l'expression régulée à la hausse de A20 dans le cœur causée par une lésion I/R.
TAM : Un pourcentage de macrophages associés aux tumeurs s'est avéré être des M2b :
Des données accumulées ont montré que les monocytes/macrophages M2b peuvent favoriser la croissance, l’invasion et la récurrence des cancers in vitro et in vivo. 25 , 28 , 162 , 163 Ces observations indiquent que les macrophages M2b peuvent être un composant important des TAM, démontrant des quantités différentes dans différents cancers.
D'autres études sont nécessaires pour étudier le pourcentage de M2b dans les TAM de différentes tumeurs et le mécanisme moléculaire par lequel les macrophages M2b favorisent le développement tumoral.
Manigances liées aux récepteurs FC
Une autre référence utile est une revue de 2015 par Li & Kimberley : « Targeting the Fc receptor in autoimmune disease »7.
Comme le titre l'indique, si des autoanticorps sont présentés aux récepteurs Fc, des troubles auto-immuns peuvent en résulter, car le corps s'attaque à lui-même. Dans cette revue, les auteurs discutent de ces mécanismes et de la manière dont nous pouvons les cibler avec des thérapies. Ce n'est pas l'objet de ce Substack, mais ils fournissent une excellente introduction aux différents FcR et à celui à cibler pour supprimer une réponse auto-immune. Cela nous indique également comment l'IgG4 fait de même.
Il est très utile pour prévenir les maladies auto-immunes ou les réactions allergiques aux piqûres d'abeilles, par exemple. Mais si l'IgG4 nous permet d'être réinfectés par le SARS-CoV-2 à forte charge virale, ou si elle supprime les réponses antitumorales, cela pourrait s'avérer fatal ou entraîner une réduction de l'espérance de vie.
Principaux points :
Les FcR sont classés en fonction de l'isotype Ig de leurs ligands, tels que IgG, IgA, IgE et IgM.
L'IgG est la classe d'anticorps la plus abondante en circulation, constituant 75 % des immunoglobulines sériques.
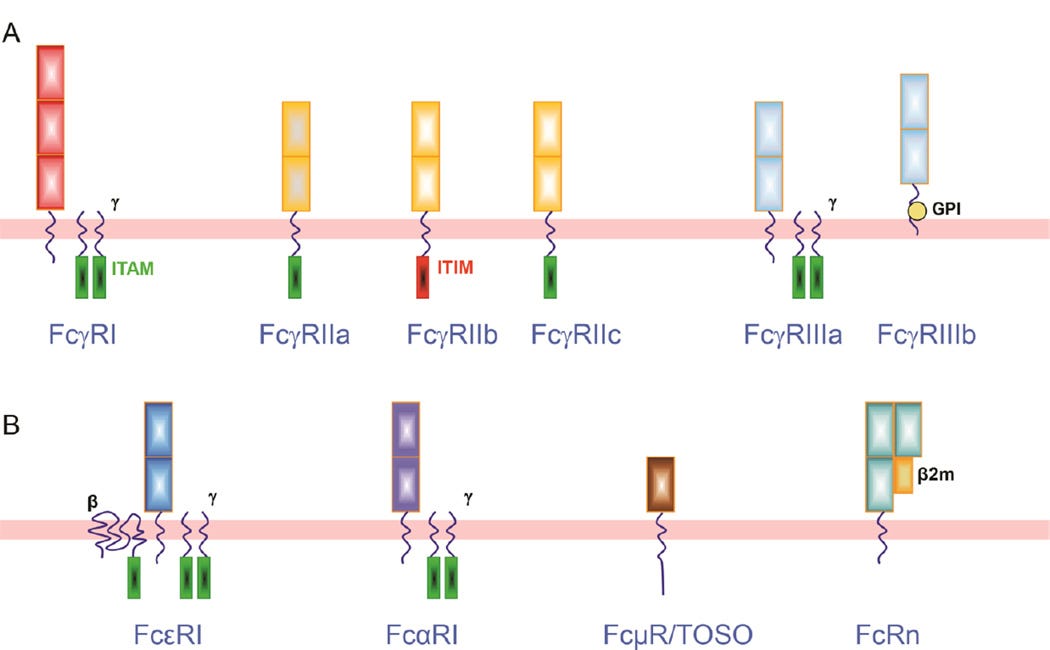
Le FcγR est un groupe de glycoprotéines de surface codées par huit gènes situés sur le chromosome 1q21-23 qui se lient à la portion Fc de l'IgG. En plus d'interagir avec l'IgG, les FcγR fonctionnent également comme récepteurs des opsonines immunitaires innées (CRP et SAP) et assurent un lien entre l'immunité innée et acquise.
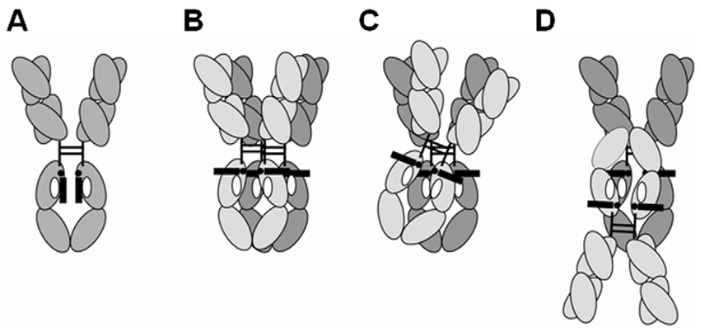
Sur la base de l'homologie structurelle et des différences d'affinité, cette famille est divisée en trois sous-familles : FcγRI (CD64), FcγRII (CD32) et FcγRIII (CD16) ( Figure 1A ).
Note:
Le seul récepteur inhibiteur est le FcγRIIb . La famille des FcR leucocytaires FcγRII est également connue sous le nom de « cluster de différenciation 32 » ou CD32.
Les FcγR fonctionnent soit comme récepteurs activateurs (FcγRI, FcγRIIa/c, FcγRIII) soit comme récepteurs inhibiteurs (FcγRIIb) , car ils signalent via des motifs d'activation ou d'inhibition de la tyrosine immunitaire (ITAM ou ITIM) pour déclencher ou inhiber les fonctions immunitaires.
ITAM = motif activateur (en vert) ; ITIM = motif inhibiteur (en rouge) :
FcγRI.
Avec trois domaines extracellulaires de type Ig, FcγRI est le seul FcγR à haute affinité (K a ~10 9 M −1 ), ce qui lui permet de se lier fortement à l'IgG monomérique. La famille FcγRI possède trois gènes (FCGRIA, FCGRIB et FCGRIC) mais seul FcγRIa, produit de FCGRIA, a été identifié comme un récepteur mature de pleine longueur [ 3 ]. FcγRI a été trouvé à la surface des monocytes, des cellules dendritiques (DC), des macrophages et des neutrophiles lorsqu'ils sont amorcés par l'interféron-γ (IFN-γ) ou le facteur de stimulation des colonies de granulocytes (G-CSF) [ 4 ].
FcγRII.
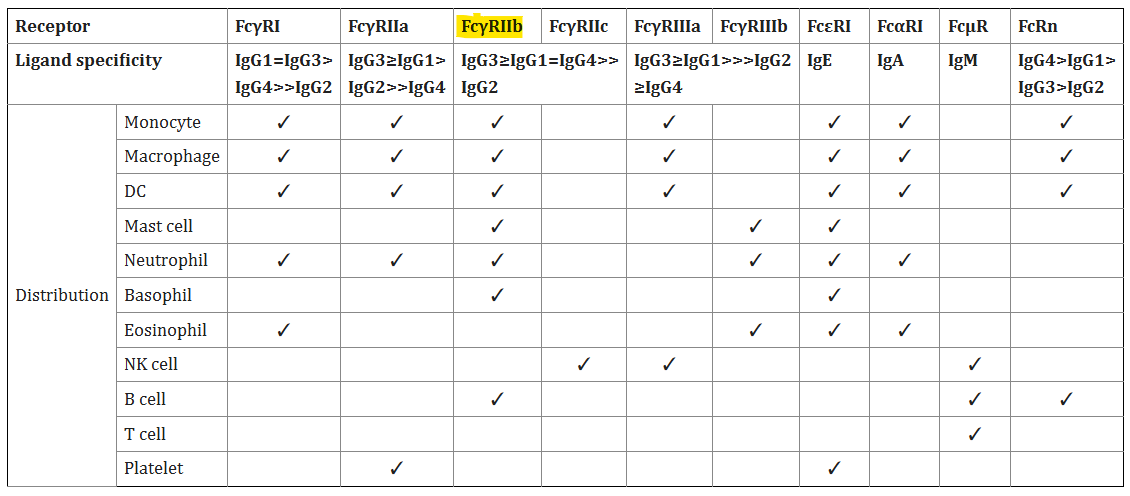
Les variants des gènes FCGR2 et FCGR3 sont situés dans le groupe de récepteurs Fc classiques à faible affinité sur le chromosome humain 1q23. La sous-classe FcγRII est composée de trois gènes (FCGR2A, FCGR2B et FCGR2C) qui codent FcγRIIa, FcγRIIb et FcγRIIc. Exprimé sur les monocytes, les neutrophiles, les cellules B et les cellules NK, FcγRII (CD32) est le FcγR le plus largement distribué avec une faible affinité de liaison à l'IgG [5].
IC = complexe immun . En d'autres termes, l'IgG4 a une affinité plus élevée pour les anticorps mixtes et combinés que pour les anticorps IgG simples (uniques) :
Avec deux domaines extracellulaires de type Ig, FcγRII a une faible affinité de liaison pour l'IgG monomérique, mais se lie facilement aux agrégats d'IgG et aux IC .
Alors que FcγRIIa et FcγRIIc contiennent un ITAM, FcγRIIb se distingue comme le seul récepteur Fcγ inhibiteur en comprenant un ITIM sur son domaine intracellulaire.
Le tableau 1 montre la distribution de FcγRIIb et ses préférences de liaison :
L’examen décrit ensuite les attributs des autres récepteurs.
Les propriétés de signalisation sont particulièrement remarquables.
Une phosphatase est une enzyme qui accélère le transfert des groupes phosphates vers d'autres composés. Lorsque cela se produit dans la voie ERK, une inactivation se produit, ce qui entraîne une inhibition de la croissance ou une réponse apoptotique dans divers types de cellules.
Une kinase fait le contraire (par phosphorylation) et est généralement impliquée dans l'activation enzymatique.
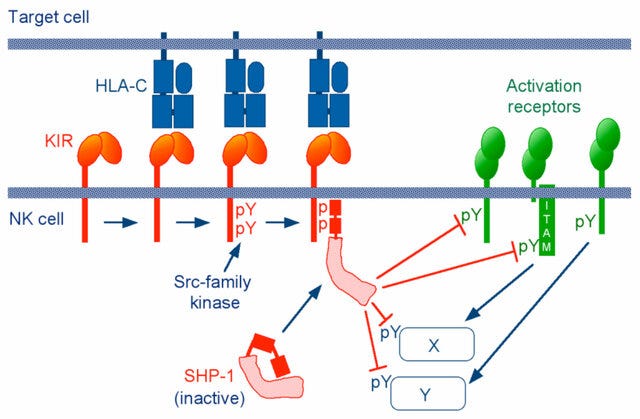
Le seuil d'activation cellulaire médié par les anticorps est réglé par les récepteurs FcR activateurs et inhibiteurs. Lors de la réticulation des récepteurs activateurs, les tyrosines de l'ITAM sont phosphorylées par les kinases de la famille Src telles que Lyn et Fyn, ce qui conduit ensuite au recrutement de la protéine kinase cytosolique Syk [ 24 , 25 ].
Les conséquences de la signalisation activatrice comprennent l’éclatement oxydatif, la dégranulation, la phagocytose, la production de cytokines et la cytotoxicité à médiation cellulaire dépendante des anticorps, ou en général, l’initiation de l’inflammation et des lésions tissulaires dans le développement de l’auto-immunité, ainsi que l’élimination des complexes immuns.
Concernant la signalisation IgG4 :
BCR = récepteur des cellules B.
SHIP = inositol phosphatase contenant le domaine SH2.
SHP-1 et SHP-2 = phosphatases 1 et 2 contenant le domaine SH2 .
Mode d’action et liens avec les maladies auto-immunes et le cancer :
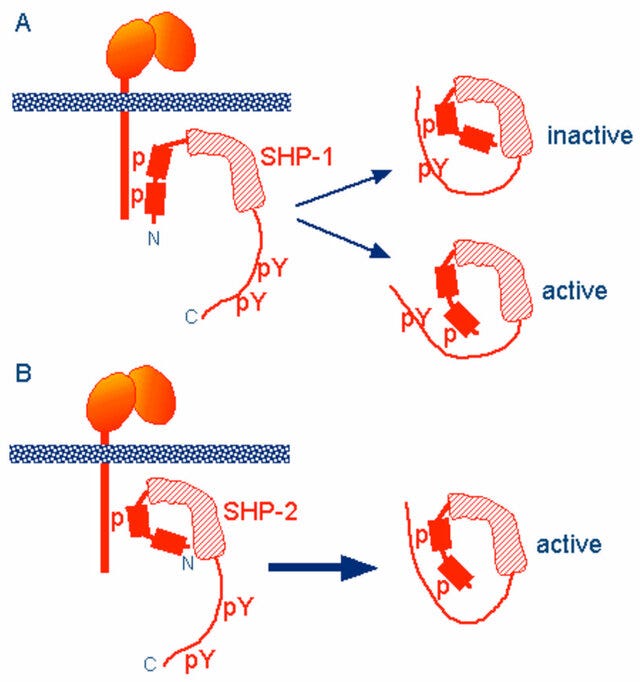
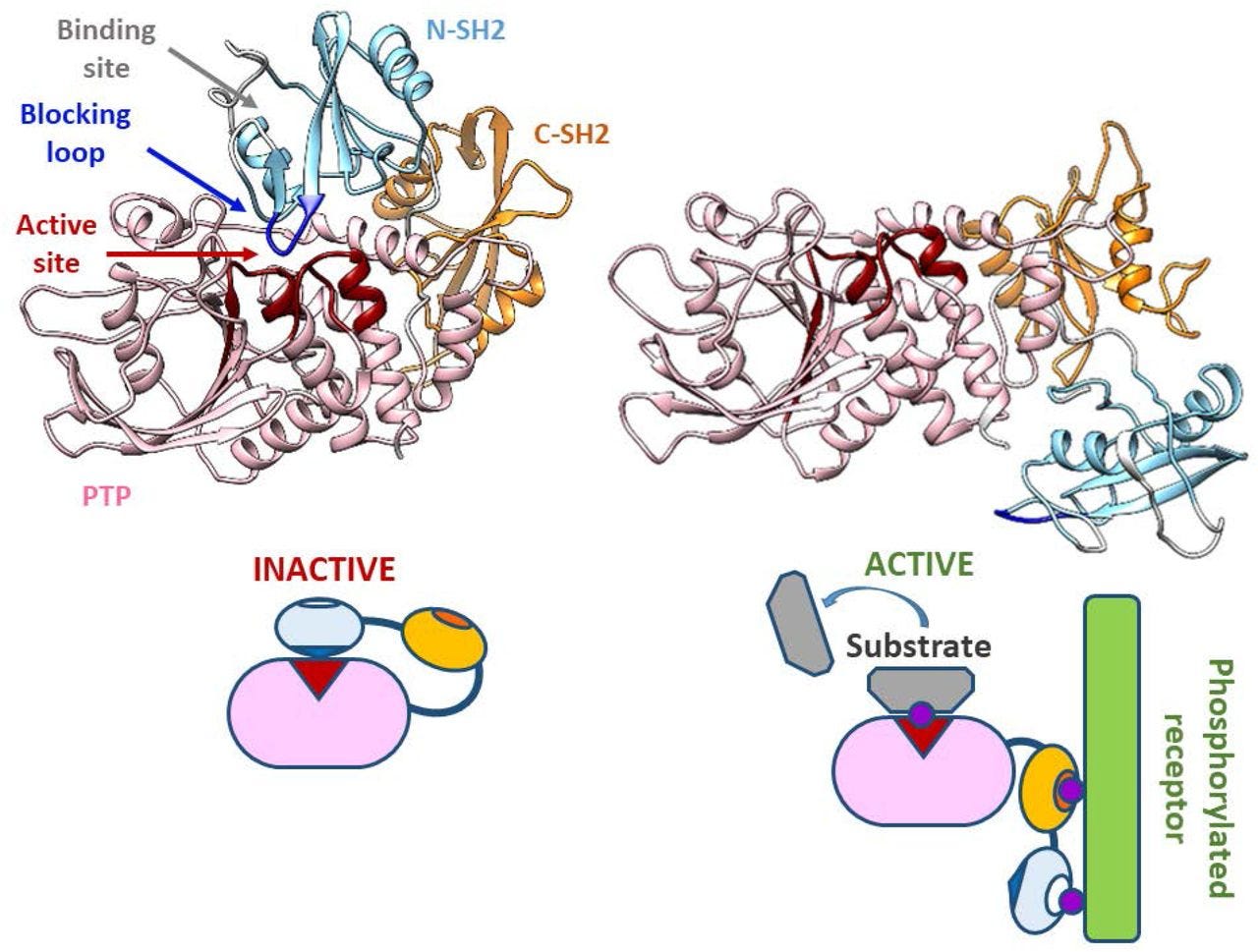
Deux résidus de tyrosine situés à l'extrémité C-terminale de SHP-1 (Y536 et Y564) sont phosphorylés par divers stimuli. La phosphorylation des résidus de tyrosine modifie la fonction et l'activité de SHP-1 en fonction de la propriété du stimulus. SHP-1 existe dans une conformation auto-inhibée ( Yang et al., 2003 ). Le domaine N-SH2 se lie étroitement au domaine PTP et bloque l'accès du substrat au domaine catalytique, gardant ainsi l'enzyme dans sa conformation inactive. Au contraire, lorsque le phosphopeptide est lié au domaine C-SH2, le domaine SH2 N-terminal est libéré du domaine PTP, ce qui lève cette auto-inhibition et active catalytiquement l'enzyme ( Figure 1B ). Les souris « mangées par les mites » ont montré une déficience de SHP-1 et ont été affectées par de nombreux troubles hématopoïétiques, y compris une hyperactivation auto-immune des macrophages , ce qui suggérait un défaut de régulation négative ( Shultz et al., 1997 ; Tsui et al., 2006 ).
Le gène SHP-1 possède deux promoteurs : le promoteur distal, présent uniquement dans les cellules épithéliales, et le promoteur proximal, actif à la fois dans les cellules épithéliales et hématopoïétiques. Par conséquent, dans des conditions normales, les niveaux d'expression de SHP-1 varient entre les cellules épithéliales et hématopoïétiques. Ce concept est soutenu par un niveau aberrant de SHP-1 dans les cancers ( Tsui et al., 2006 ). Dans les cancers hématopoïétiques, tels que le myélome, la méthylation du promoteur inhibe l'expression de SHP-1. Inversement, il a été constaté que SHP-1 est surexprimé dans les cancers épithéliaux, tels que le cancer du sein ( Tsui et al., 2006 ).
Extrait de : « Stratégie de traitement de la leucémie ciblant SHP-1,2 et SHIP » (2021)
En d'autres termes, l'ITIM phosphorylé inhibe la signalisation MAPK en modifiant la conformation de SHP-1 et SHP-2 pour bloquer l'accès aux sites actifs.
Représentations graphiques de ce qui précède :
Un diagramme de Richardson (ou en ruban) montrant les mécanismes d'inhibition plus en détail :
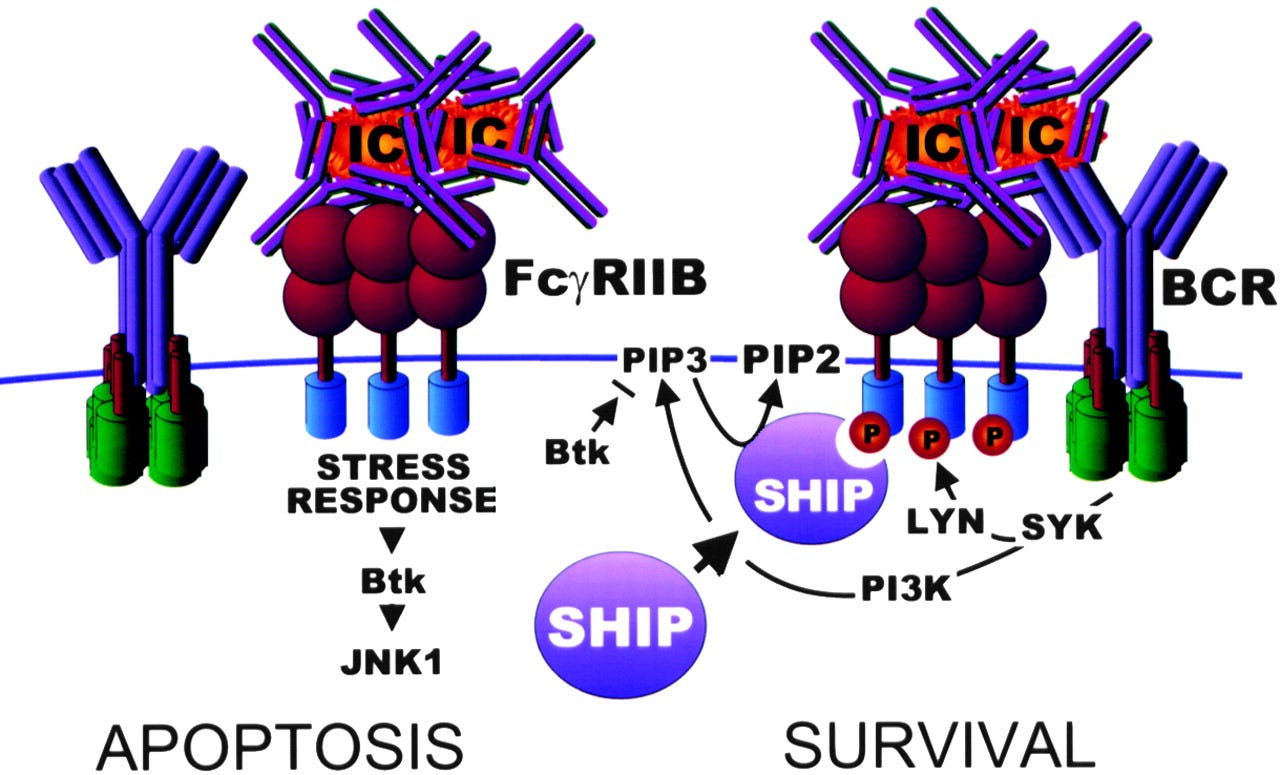
Lorsque le FcγRIIb inhibiteur est co-engagé avec les récepteurs Fc activateurs ou le BCR, l'ITIM phosphorylé sur tyrosine recrute les phosphatases contenant le domaine SH2 SHIP ou SHP-1[ 26 ].
Btk est une autre kinase importante dans la voie de signalisation BCR. La liaison de l'IgG4 à FcγRIIb contribue également à inhiber ses effets :
Dans les cellules B, la cascade s'étend jusqu'à dissocier Btk et PLC-γ du signalosome BCR et réduire l'afflux de calcium [ 27 ]. Grâce à son ITIM, FcγRIIb sert de régulateur négatif des cascades inflammatoires déclenchées par les complexes immuns.
Si la signalisation FcγRIIb est supprimée ou diminuée en raison de mutations, des troubles auto-immuns peuvent survenir.
( LED = lupus).
Le seul FcR inhibiteur, FcγRIIb, joue le rôle de régulateur négatif essentiel dans les réactions induites par les complexes immuns. Chez les souris dépourvues de FcγRIIb, les symptômes auto-immuns sont exacerbés et une restauration partielle de l'expression de FcγRIIb sur les cellules B a permis d'empêcher les souris de développer un phénotype de type LES [ 46 – 48 ].
Le rôle suppresseur important de FcγRIIb dans le développement de l'auto-immunité est également confirmé par de multiples observations chez l'homme selon lesquelles les polymorphismes de FcγRIIb sont associés au LES en affectant soit le niveau de signalisation, soit le niveau d'expression [ 49 – 52 ]. Il a également été signalé que FcγRIIb sur les cellules B mémoires est dérégulé dans le LES [ 53 , 54 ].
En tant que cible unique, le traitement devrait être facile, mais il est difficile d'obtenir un anticorps qui cible l'ITIM FcγRIIb sans stimuler accidentellement l'ITAMS FcγRIIa ou FcγRIIc et aggraver la maladie :
Ces caractéristiques inhibitrices uniques font de FcγRIIb un candidat important pour les cibles thérapeutiques dans l'auto-immunité. Cependant, pendant de nombreuses années, la thérapie par anticorps contre FcγRIIb a été freinée par la grande difficulté à distinguer FcγRIIb de FcγRIIa en raison de leurs séquences extracellulaires hautement homologues.
Concernant les mécanismes d’immunosuppression par IgG4 :
Le niveau d'expression de FcγRIIb sur les cellules dendritiques dérivées de monocytes (mDC) définit le seuil d'activation cellulaire médiée par TLR4 en réponse à la stimulation des IC. FcγRIIb inhibe la maturation des DC médiée par TLR4, réduit la sécrétion de cytokines pro-inflammatoires, ce qui à son tour inhibe la prolifération des lymphocytes T, et incite les lymphocytes T à produire des cytokines Th2 anti-inflammatoires [ 152 ].
Le mécanisme de cet effet peut être l'interaction des composants de signalisation. L'activation de FcγRIIb ITIM recrute SHIP phosphorylé et régule à la baisse PI3K et Akt, qui sont des molécules clés dans la signalisation TLR4. Conformément aux données expérimentales, un niveau élevé d'expression de FcγRIIb sur les DC est associé à une activité réduite de la maladie et à une quiescence chez les patients atteints de PR sans médicaments antirhumatismaux [ 152 ]. De même, l'expression de FcγRIIb ou l'absence de FcγRIIa ou de chaîne γ de FcR sur les macrophages et les DC peuvent exercer des rôles régulateurs négatifs dans les réponses TLR4 [ 153 – 155 ].
C'est pourquoi vous ne voulez pas d'effets hors cible, par exemple en activant accidentellement FcγRII a lorsque vous essayez d'activer la signalisation FcγRII b .
Vous risquez de déclencher une boucle de rétroaction positive :
Chez les neutrophiles humains, le LPS/TLR4 déclenche une expression accrue de FcγRIIa. Le FcγRIIa et les complexes immuns peuvent également activer les cascades de signalisation TLR4 chez les neutrophiles sensibilisés au LPS [ 156 ]. Les mécanismes moléculaires de cette interaction ne sont pas entièrement compris, mais elle dépend de Btk [ 156 ].
La revue « La famille humaine FcγRII (CD32) des FcR leucocytaires dans la santé et la maladie » par Anania et al . (2019)8ajoute encore plus à notre compréhension :
Les niveaux d'expression de FcγRIIB sont influencés par l'exposition aux cytokines. Les cytokines telles que l'IL-10 , l'IL-6 et la dexaméthasone augmentent l'expression de FcγRIIB, tandis que le TNF-α , le C5a et l'IFN-γ inhibent l'expression (18–20).
Sur les réponses cellulaires :
Les cellules dendritiques folliculaires (FDC) proviennent des follicules primaires et des centres germinatifs des organes lymphoïdes secondaires et tertiaires (SLO et TLO)9.
C'est probablement la raison pour laquelle les anticorps IgG4 persistent après une exposition à des agents d'ARNm modifiés :
La FcγRIIB est régulée à la hausse après stimulation antigénique par des complexes immuns sur les cellules dendritiques folliculaires (FDC) (98). Les FDC retiennent les complexes immuns et les recyclent périodiquement vers leur membrane plasmique, un processus considéré comme important dans le développement de la mémoire immunitaire des cellules B (99).
La présentation de complexes immuns par des FDC activés exprimant FcγRIIB fournit des antigènes aux cellules B sous une forme hautement immunogène en multimérisant les antigènes, réticulant ainsi de manière extensive plusieurs BCR, minimisant l'inhibition médiée par FcγRIIB ITIM des cellules B et fournissant des signaux de co-stimulation (100).
Les cellules dendritiques dérivées de monocytes (moDC) qui ont été traitées avec de l'IFNγ pour réguler à la hausse leurs FcγR activateurs (FcγRI et FcγRIIA) ont eu une maturation cellulaire médiée par l'IgG accrue, tandis que les moDC traitées avec des concentrations anti-inflammatoires d'IgG monomère soluble (IVIg) pour augmenter l'expression de FcγRIIB ont eu une maturation cellulaire diminuée (18).
Les cytokines anti-inflammatoires connues pour leur implication dans la commutation de classe IgG4 conduisent à une expression accrue de FcγRIIB, tout en empêchant l'expression des cytokines pro-inflammatoires par l'IgG :
De même, les monocytes avec une expression accrue de FcγR activateurs sur FcγRIIB comme induit par IFNγ ou TNFα avaient une production accrue de cytokines déclenchée par IgG, tandis que les monocytes avec une expression accrue de FcγRIIB par IL-4 et IL-10 empêchaient la production de cytokines déclenchée par IgG (103).
De plus, les macrophages de souris FcγRIIB−/− ont développé des réponses inflammatoires robustes après exposition à des concentrations inférieures au seuil de complexes immuns qui n'ont pas réussi à induire de réponses dans les cellules exprimant FcγRIIB, démontrant ainsi le rôle de FcγRIIB dans l'établissement d'un « seuil » pour l'activation cellulaire (104).
Sur les effets disproportionnés de l’IgG4 par rapport à l’IgG1 et à l’IgG3 :
… Le FcγRIIB se lie à l’IgG4 mais pas à l’IgG2 et, de plus, se lie à l’IgG1 et à l’IgG3 avec une affinité environ 10 fois inférieure à celle du FcγRIIA activateur.
Vous ne le souhaitez pas, mais l’IgG4 médiée par l’ARNm modifié appuie sur le bouton d’arrêt d’urgence de la réponse immunitaire :
Ceci est cohérent avec sa puissante fonction inhibitrice physiologique, car des affinités de liaison des IgG égales ou supérieures à celles des récepteurs activateurs pourraient autrement empêcher les réponses pro-inflammatoires nécessaires pour résister à l'infection. Sans surprise, FcγRIIC a les mêmes propriétés de liaison des IgG que FcγRIIB ( 6 ).
Une mutation du gène FcγRIIb qui entraîne une moindre immunosuppression est naturellement sélectionnée dans les zones exposées au paludisme, car elle confère une capacité de survie accrue.
Cela met également en évidence les conséquences potentiellement désastreuses d’un changement de classe d’IgG4 au niveau de la population par des programmes de vaccination de masse gravement négligents (ou délibérés) :
La variante hypofonctionnelle FcγRIIB-Thr 232 est enrichie dans les populations des zones d'endémie palustre. Cela suggère qu'une modulation réduite des réponses par FcγRIIB et une augmentation conséquente de l'activation des cellules B et des cellules inflammatoires confèrent un avantage de survie dans ces populations ( 132 , 163 ).
En effet, les réponses FcR activatrices améliorées, y compris la capacité phagocytaire accrue et la production de TNF par les cellules innées et les réponses des cellules B améliorées sont mises en évidence par des titres d'anticorps spécifiques du paludisme élevés ( 164 ).
Revenons à notre dernier Substack :
Cancer
Les rôles du FcγR dans le cancer sont en grande partie liés à l'exploitation des fonctions effectrices dépendantes des anticorps telles que l'ADCC ou l'ADCP par les mAbs thérapeutiques pendant le traitement [revu dans ( 2 , 139 )]. Cependant, il semble également que la thérapie par mAb puisse également avoir des avantages thérapeutiques à long terme.
Vous devez activer le FcγRIIA, mais pas le FcγRIIb, pour combattre les tumeurs :
Des études sur les DC indiquent que l’activation de FcγRIIA est nécessaire et suffisante pour induire une forte immunité cellulaire anti-tumorale des cellules T induisant des effets antitumoraux à long terme de type vaccinal ou « vaccinal » chez les souris humanisées ( 48 ).
L'engagement de FcγRIIA a induit la maturation des DC et la régulation positive des molécules costimulatrices, les préparant à une présentation optimale de l'antigène et à une présentation croisée, stimulant ainsi la mémoire à long terme des cellules T antitumorales ( 48 ).
À l'inverse, le rôle inhibiteur de FcγRIIB peut être désavantageux pour les thérapies à base d'anticorps et d'autres thérapies de stimulation immunitaire. Ainsi, le blocage de la fonction inhibitrice de FcγRIIB sur les cellules effectrices ou les cellules présentatrices d'antigènes telles que les cellules dendritiques pourrait être une stratégie pour améliorer les réponses immunitaires antitumorales pendant l'immunothérapie ( 18 , 182 , 183 ).
C'est compliqué
Les produits à base d'ARNm ont été mis au point alors que les mécanismes sous-jacents de l'activation et de la suppression immunitaires n'étaient pas encore entièrement compris. Ils ne le sont toujours pas.
Les FcγRIIb peuvent également s'agréger pour former des complexes, conduisant à l'apoptose des cellules B. Dans les centres germinatifs des ganglions lymphatiques, cela peut avoir pour effet de sélectionner négativement les cellules B avec des BCR pour des antigènes spécifiques10:
Getahun et Cambier (2016) approfondissent davantage et mettent en évidence les domaines dans lesquels il existe des lacunes dans nos connaissances.
Extrait de « Des ITIM, des ITAM et des ITAMis, revisitant la signalisation du récepteur Fc des immunoglobulines »11:
… La voie de signalisation par laquelle l'agrégation homotypique de FcγRIIb induit l'apoptose n'est pas encore élucidée. Cette voie est indépendante des kinases de la famille ITIM, SHIP-1 et Src, mais FcγRIIb est phosphorylée et, bien que leur rôle exact ne soit pas clair, les membres de la voie des kinases de la famille c-Abl, c-Abl et Arg, se sont révélés importants ( 40 ).
Les cellules pré-B répondent à l'agrégation de FcγRIIb en subissant une apoptose , mais présentent également une migration cellulaire altérée en raison de l'activation de SHIP-1. La manière dont SHIP-1 s'active n'est pas claire car dans ces cellules, FcγRIIb ne semble pas être phosphorylé ( 41 ) .
… Enfin, il a été démontré que par un mécanisme mal compris impliquant la dépolymérisation de l’actine, les complexes FcαRI-SHP-1 se transloquent dans des radeaux lipidiques avec des récepteurs activateurs, permettant éventuellement la trans-déphosphorylation SHP-1 des récepteurs voisins ( 72 ).
Cette colocalisation non covalente permettrait à SHP-1 d'avoir un potentiel inhibiteur plus large , à l'image de la gamme plus large de SHIP-1 ( 73 , 74 ). Ce phénomène n'est pas propre à FcαRI, une activité inhibitrice similaire a été observée dans le cas de FcγRIIa ( 75 ).
L'ITAM FcγRIIa peut également être inhibiteur s'il est stimulé par des IgG intraveineuses (IVIG) ou par des fragments F(ab')2 . Ces types de mécanismes contribuent à expliquer pourquoi certains traitements mAB ont une faible efficacité chez certains patients, ou pourquoi cette efficacité diminue.
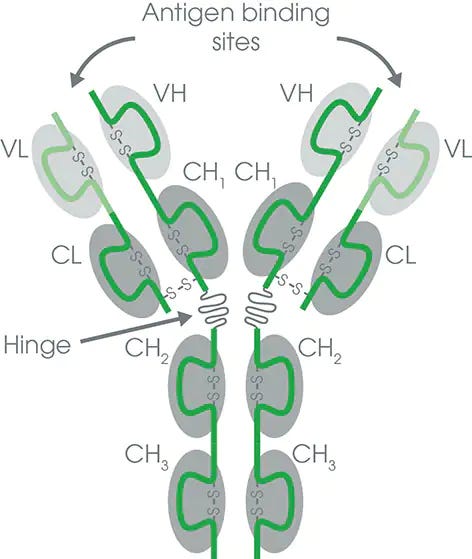
Les anticorps F(ab') 2 sont générés par digestion par la pepsine d'anticorps IgG entiers (voir ci-dessous la structure de l'IgG) pour éliminer la majeure partie de la région Fc tout en laissant intacte une partie de la région charnière. Les fragments F(ab') 2 ont deux parties F(ab) de liaison à l'antigène liées ensemble par des liaisons disulfures et sont donc divalents avec un poids moléculaire d'environ 110 kDa.
Extrait de « Fragments d'immunoglobuline F(ab) et F(ab')2 »
La stimulation par IVIG ou F(ab') 2 anti-FcγRIIa a entraîné une signalisation inhibitrice par FcγRIIa indépendante de FcγRIIb . Une faible phosphorylation d'ITAM entraînerait un recrutement transitoire de Syk suivi d'un recrutement stable de SHP-1.
… C'est compliqué, mais dans le contexte de la stimulation par des ligands d'avidité différente, les ITAM et les ITIM semblent avoir un énorme potentiel pour ajuster les réponses biologiques. Des substituts appropriés de ligands qui activent la signalisation inhibitrice peuvent avoir une grande utilité en clinique.
miR-222, tolérance et IgG4-RD
Le microARN-222 agit généralement pour favoriser la croissance tumorale (c'est-à-dire qu'il s'agit d'un oncomiR ) et il agit comme biomarqueur pour plusieurs cancers. Il s'agit notamment du cancer du sein , du cancer du foie , du cancer du pancréas , du cancer de la prostate , du cancer gastrique , du cancer colorectal , du gliome , du myélome multiple et du mélanome malin.12.
Extrait de « NF-kB et c-Jun induisent l’expression des gènes oncogènes miR-221 et miR-222 dans les cellules du carcinome de la prostate et du glioblastome »13(2011) par Galardi et al. :
… les miRNA sont des acteurs clés du cancer, où ils régulent tous les aspects principaux de la tumorigenèse et de la progression tumorale, depuis les premières étapes initiales jusqu'à la formation et la propagation des métastases ( 2 ). Les miRNA dont l'expression est positivement corrélée à l'oncogenèse sont souvent appelés « oncomiR ».
Parmi ceux-ci, miR-221 et miR-222 sont une paire de miRNA codés en cluster sur le chromosome X, largement surexprimés dans une grande variété de cancers humains, où il a été démontré qu'ils jouent leur rôle oncogène via la régulation négative de plusieurs suppresseurs de tumeurs tels que p27, p57, PTEN et bien d'autres ( 3 , 4 ).
Dans nos travaux précédents, nous avons démontré que miR-221 et miR-222 sont surexprimés dans le carcinome de la prostate et dans le glioblastome ( 5–7 ), et dans les deux tumeurs, ils régulent à la baisse l'inhibiteur du cycle cellulaire p27 en altérant la traduction de son ARNm ( 6 , 7 ).
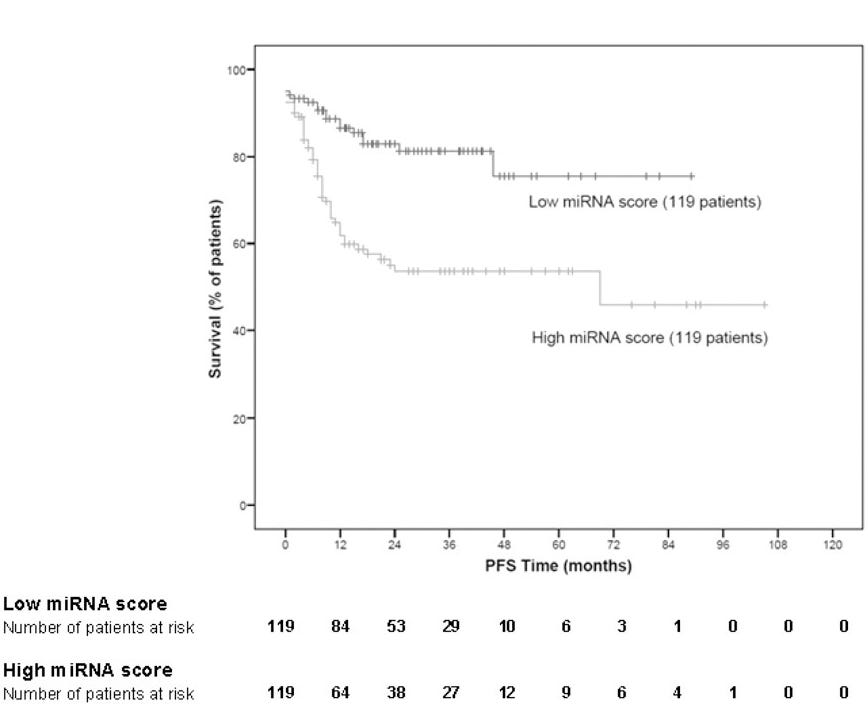
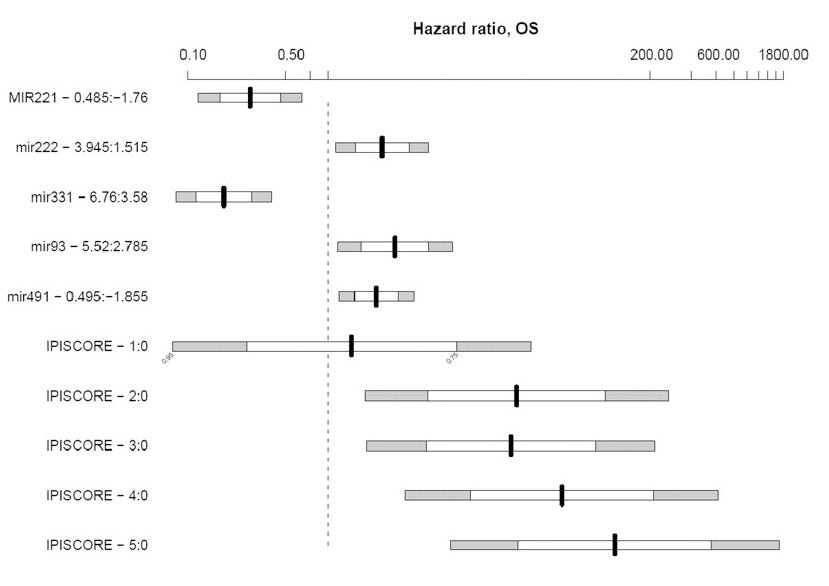
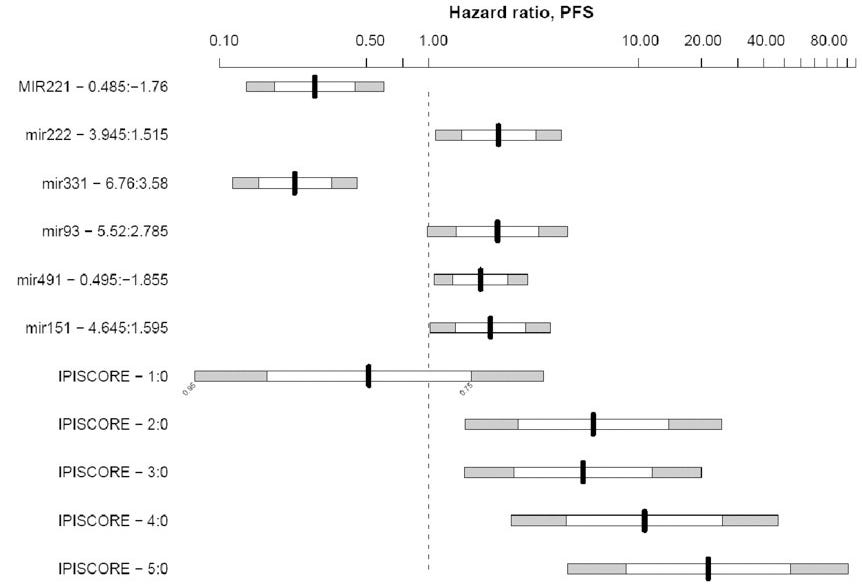
Montes-Moreno et al. (2011) ont produit des chiffres utiles montrant l'association entre des niveaux élevés d'expression d'oncomiR et la mortalité, ainsi que les rapports de risque pour le miR-222 et le lymphome diffus à grandes cellules B.
De « Expression de miRNA dans le lymphome diffus à grandes cellules B traité par chimio-immunothérapie »14:
Outre le cancer, le miR-222 augmente également le nombre de phénotypes de macrophages CCL1 et M2b . Existe-t-il un lien entre CCL1 (une chimiokine qui attire les cellules immunitaires) et l'IgG4-RD ?
« Implication possible de l’interaction CCL1-CCR8 dans le recrutement lymphocytaire dans la cholangite sclérosante liée aux IgG4 »15Une étude de 2013 réalisée par Zen et al. montre qu'il y en a probablement, au moins dans le cas de la cholangite sclérosante primitive (CSP) liée aux IgG4 et de la pancréatite auto-immune (AIP) , bien qu'ils n'aient pas analysé les changements de repliement des miRNA :
En conjonction avec des niveaux d'expression plus élevés d'IL-4 et d'IL-10, les valeurs d'expression des transcrits CCL1 et CCR8 étaient significativement plus élevées dans l'IgG4-SC/AIP que dans l'IgG4 PSC faible (p = 0,002) et l'IgG4 PSC élevé (p = 0,023).
Les CCL1 et CCR8 étaient également surexprimés dans les PSC à forte concentration d'IgG4 par rapport aux PSC à faible concentration d'IgG4 (p = 0,023). Aucune différence n'a été observée pour les CCL17, CCL22 et CCR4.
L'hybridation in situ a révélé que CCL1 était principalement exprimé dans l'épithélium du canal pancréatique, les glandes péribiliaires et les cellules endothéliales vasculaires, y compris celles impliquées dans la phlébite oblitérante dans les IgG4-SC/AIP , contrairement aux PSC à haute teneur en IgG4 où ce facteur chimiotactique était positif dans plusieurs lymphocytes infiltrants.
Ces sites exprimant CCL1 ont été infiltrés par des lymphocytes CCR8 + . À l'immunohistochimie, les lymphocytes GATA3 + Th2 et les Tregs FOXP3 + étaient significativement plus nombreux dans les IgG4-SC/AIP, le rapport cellules GATA3 + /T-bet + étant décalé en faveur des Th2 dans les zones périductales et périvasculaires.
Dans le contexte de la tolérance aux lipopolysaccharides bactériens (LPS, endotoxine), conduisant à une immunosuppression et à un risque de décès par septicémie, Seeley et al. ont publié « Induction de la mémoire immunitaire innée via le ciblage par microARN des facteurs de remodelage de la chromatine »16(2018).
Ils ont découvert que la régulation positive du miR-222 est associée à des lésions organiques et à un mauvais pronostic :
Une exposition prolongée à des produits microbiens, par exemple le lipopolysaccharide (LPS), peut induire une forme de mémoire immunitaire innée qui atténue les réponses ultérieures à des agents pathogènes non apparentés (« tolérance au LPS »).
La septicémie, qui continue d’avoir un taux de mortalité élevé, est une réponse immunitaire systémique dérégulée à une infection disséminée.
Chez certains patients, cela entraîne une période d’immunosuppression (« immunoparalysie ») 1 avec une production réduite de cytokines inflammatoires 2 , une augmentation des infections secondaires 3 et un risque accru de défaillance d’organe et de mortalité 4 .
La tolérance au LPS récapitule plusieurs caractéristiques clés de l’immunosuppression associée au sepsis 5 . Bien que divers changements épigénétiques aient été observés dans les macrophages tolérés 6 – 8 , la base moléculaire de la tolérance, de l’immunoparalysie et d’autres formes de mémoire immunitaire innée reste floue.
Ici, nous avons effectué un criblage pour les microARN associés à la tolérance (miARN) et identifié les miR-221/222 comme régulateurs de la reprogrammation fonctionnelle des macrophages pendant la tolérance au LPS.
Une stimulation prolongée avec LPS chez la souris conduit à une expression accrue de miR-221/222, qui régule le gène 1 lié à Brahma (Brg1), provoquant le silençage transcriptionnel d'un sous-ensemble de gènes inflammatoires qui dépendent du remodelage de la chromatine médié par SWI/SNF- (SWItch/Sucrose Non-Fermentable) et STAT- (transducteur de signal et activateur de la transcription), et favorise la tolérance.
Chez les patients atteints de sepsis, l'augmentation de l'expression de miR-221/222 est corrélée à une immunoparalysie et à une augmentation des lésions organiques. Nos résultats montrent donc que des microARN spécifiques peuvent réguler la tolérance des macrophages et peuvent servir de biomarqueurs d'immunoparalysie et de mauvais pronostic chez les patients atteints de sepsis.
En reliant les deux études précédentes, au moins un autre article montre que l'IgG4-RD, y compris la cholangite sclérosante intrahépatique liée à l'IgG4 , peut également conduire à une septicémie comme résultat 17:
Nous rapportons un cas de coagulation intravasculaire pré-disséminée causée par une inflammation suppurée secondaire chez un patient atteint de cholangite sclérosante liée aux immunoglobulines (Ig) G4. Le patient était un homme de 78 ans chez qui une sténose localisée de la voie biliaire intrahépatique a été constatée sans autre sténose ni symptôme de la voie biliaire. Il a subi une résection chirurgicale 6 mois plus tard pour une cholangite aiguë sévère et une septicémie causées par une obstruction de la voie biliaire.
Extrait de : « Cholangite sclérosante intrahépatique liée aux IgG4 entraînant une septicémie causée par une inflammation suppurée secondaire : rapport d'un cas » (2012)
Je n'ai cependant pas trouvé d'articles suggérant l'inverse, c'est-à-dire que la septicémie induit une IgG4-RD, peut-être parce que les cellules B sont également supprimées. Cependant, des recherches montrent qu'un traitement pour l'IgG4-RD, le Rituximab , est associé à une incidence plus élevée de complications infectieuses, y compris la septicémie.
Le rituximab est un anticorps monoclonal (MAB) qui se fixe aux protéines CD20 des cellules B. Il provoque la mort des cellules B par de multiples mécanismes18, ce qui en fait un traitement contre certains cancers du sang (comme le lymphome non hodgkinien, LNH ) et d'autres maladies auto-immunes. Le mode d'action complet n'est pas entièrement élucidé.
Extrait de : « Thérapie ciblée par les cellules B pour les maladies liées aux immunoglobulines G4 »19(2021) par Yamamoto :
De nombreux patients ont eu besoin d'un traitement d'entretien même après un traitement d'induction réussi par rituximab. Omar et al. ont montré que le risque de rechute avait tendance à être plus faible avec le traitement d'entretien par rituximab qu'avec le seul traitement d'induction par rituximab après la rémission [ Citation12 ].
Quarante-trois patients atteints de pancréatite auto-immune et de cholangite sclérosante liée aux IgG4 ont été divisés en deux groupes : ceux qui ont pris du rituximab uniquement au moment du traitement d'induction et ceux qui ont poursuivi le traitement d'entretien par rituximab après la rémission.
Le groupe d'entretien avait un taux de rechute significativement plus faible de 11 % ; cependant, les complications infectieuses (pneumonie, septicémie due à une infection urinaire, colite à Clostridium difficile, abcès dentaire, sinusite et diverticulite) étaient plus fréquentes (20,7 %) dans le groupe d'entretien au rituximab [ Citation39 ].
Nous avons également observé de bons résultats avec le traitement d'induction par rituximab chez les patients présentant des rechutes répétées. Au début, les symptômes cliniques (Figure 2) et les taux sériques d'IgG4 se sont améliorés rapidement chez tous les patients. L'utilisation des glucocorticoïdes a donc été réduite progressivement et le rituximab a été administré après chaque rechute (Figure 2) ; cependant, l'intervalle entre les administrations de rituximab est devenu progressivement plus court. Les patients ont finalement présenté un échec secondaire [ Citation40 ], ce qui pose la question du mode d'administration pour l'utilisation à long terme du rituximab.
À ce stade, il n'existe pas de rapport sur une efficacité atténuée due à l'apparition d'anticorps anti-chimériques (HACA) chez les patients traités par rituximab pour IgG4-RD, mais ce phénomène a été confirmé dans le traitement par rituximab du lupus érythémateux disséminé pédiatrique [ Citation41 ] et du syndrome de Sjögren [ Citation42 ]. Les HACA peuvent également être une cause possible d'échec secondaire dans cette maladie. L'optimisation du traitement d'entretien par rituximab est donc essentielle.
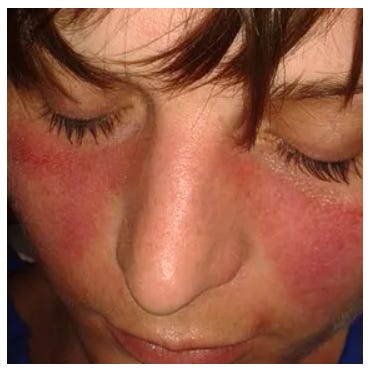
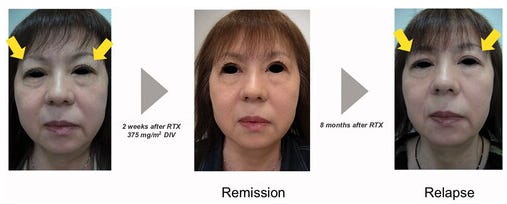
Figure 2. Modifications de l'apparence faciale du patient atteint de dacryoadénite liée à l'immunoglobuline G4. Le rituximab a rapidement amélioré le gonflement des paupières supérieures et réduit les taux de stéroïdes, mais les cas ont présenté une rechute dans les 3 ans.
Le rituximab élimine vos lymphocytes B, et il faut des mois, voire des années, pour que les niveaux se normalisent après l'arrêt du traitement :
Dans le lupus érythémateux disséminé, le traitement par rituximab chez les patients résistants aux glucocorticoïdes a entraîné la disparition des cellules B naïves CD19 + IgD + CD27 − , des cellules B mémoires à commutation de classe CD19 + IgD − CD27 + et des cellules B mémoires CD19 + IgD − CD27 − du sang périphérique en 4 semaines.
Après cette période, les cellules B naïves récupèrent en 3 à 9 mois environ et sont maintenues pendant 2 à 6 ans.
Chez les patients atteints de lupus érythémateux disséminé en rémission pendant une période prolongée, les cellules B mémoires et les plasmoblastes restent absents pendant 6 mois à 6 ans.
Le rituximab inhibe l'activation et la différenciation des cellules T, qui sont normalement médiées par les cellules B mémoires via des molécules co-stimulatrices (augmentation des cellules T naïves CD4 + et diminution des cellules T CD40L + CD4 + et des cellules T ICOS + CD4 + ), régulant ainsi la maladie [ Citation44 ].
Il a cependant été rapporté que certains patients atteints de lupus érythémateux disséminé ont rechuté après une rémission avec rituximab sans modification de la lignée des cellules B mais avec des anomalies de la lignée des cellules T, telles qu'une augmentation des cellules T mémoire CD4 + CD45RO + et une augmentation de l'expression d'ICOS et de CD69 dans les cellules T CD4 + [ Citation45 ]. Le même phénomène pourrait se produire dans le cas de l'IgG4-RD.
Remarques de clôture
Je vais m'arrêter ici car j'ai atteint la limite de mots que je m'étais imposée. J'ai dû réduire cette critique de 2/3 telle quelle, car elle approchait la taille d'une thèse.
L’IgG4-RD et ses mécanismes et traitements associés pourraient facilement remplir un livre, et il existe encore de grandes lacunes dans nos connaissances.
La compréhension de ces mécanismes est la première étape pour établir des diagnostics plus précis et plus rapides, et pour découvrir des traitements plus efficaces. Les mécanismes destructeurs des produits d'ARNm créés expérimentalement ne font qu'ajouter à la complexité.
Merci d'avoir lu.
Les revues de littérature scientifique de DoorlessCarp sont une publication soutenue par les lecteurs. Pour recevoir de nouveaux articles et soutenir mon travail, pensez à devenir un abonné gratuit ou payant.
Références
Jain, Shilpi, Sanjeev Kumar, Lilin Lai, Susanne Linderman, Ansa A. Malik, Madison L. Ellis, Sucheta Godbole, et al. « Le booster monovalent XBB.1.5 améliore la liaison et la neutralisation des anticorps contre les variants émergents du SARS-CoV-2 Omicron ». bioRxiv, 5 février 2024. https://doi.org/10.1101/2024.02.03.578771 .
Jain S, Kumar S, Lai L, et al. Le rappel monovalent XBB.1.5 améliore la liaison et la neutralisation des anticorps contre les variants émergents du SARS-CoV-2 Omicron. Publié en ligne le 5 février 2024 : 2024.02.03.578771. doi : 10.1101/2024.02.03.578771
Gelderloos AT, Verheul MK, Middelhof I, et al. La vaccination répétée par ARNm contre la COVID-19 entraîne un changement de classe IgG4 et une diminution de l'activation des cellules NK par des anticorps spécifiques de S1 chez les personnes âgées. Immunité et vieillissement . 2024;21(1):63. doi: 10.1186/s12979-024-00466-9
Rubio-Casillas A, Redwan EM, Uversky VN. Le SARS-CoV-2 induit-il la synthèse d'IgG4 pour échapper au système immunitaire ? Publié en ligne le 9 août 2023. doi: 10.20944/preprints202308.0776.v1
Bianchini R, Karagiannis SN, Jordakieva G, Jensen-Jarolim E. Le rôle de l'IgG4 dans le réglage fin de la tolérance dans l'allergie et le cancer à médiation IgE. Revue internationale des sciences moléculaires . 2020 ; 21(14) : 5017. doi : 10.3390/ijms21145017
Wang L xun, Zhang S xi, Wu H juan, Rong X lu, Guo J. Polarisation des macrophages M2b et ses rôles dans les maladies. Journal of Leukocyte Biology . 2019;106(2):345-358. doi: 10.1002/JLB.3RU1018-378RR
Li X, Kimberly RP. Ciblage du récepteur Fc dans les maladies auto-immunes. Opinion d'expert sur Ther Targets . 2014;18(3):335-350. doi: 10.1517/14728222.2014.877891
Anania JC, Chenoweth AM, Wines BD, Hogarth PM. La famille humaine FcγRII (CD32) de FcR leucocytaire dans la santé et la maladie . Front Immunol . 2019;10. doi: 10.3389/fimmu.2019.00464
Kranich J, Krautler NJ. Comment les cellules dendritiques folliculaires façonnent l'antigénome des cellules B. Front Immunol . 2016;7. doi: 10.3389 /fimmu.2016.00225
Pearse RN, Kawabe T, Bolland S, Guinamard R, Kurosaki T, Ravetch JV. Le recrutement SHIP atténue l'apoptose des cellules B induite par FcγRIIB. Immunité . 1999;10(6):753-760. doi: 10.1016/S1074-7613(00)80074-6
Getahun A, Cambier JC. Des ITIM, des ITAM et des ITAMis, revisitant la signalisation du récepteur Fc des immunoglobulines. Immunol Rev . 2015;268(1):66-73. doi: 10.1111/imr.12336
Song J, Ouyang Y, Che J, et al. Valeur potentielle des miR-221/222 comme biomarqueurs diagnostiques, pronostiques et thérapeutiques pour les maladies. Front Immunol . 2017;8. doi: 10.3389/fimmu.2017.00056
Galardi S, Mercatelli N, Farace MG, Ciafrè SA. NF-kB et c-Jun induisent l'expression des miR-221 et miR-222 oncogènes dans les cellules du carcinome de la prostate et du glioblastome . Nucleic Acids Res . 2011;39(9):3892-3902. doi: 10.1093/nar/gkr006
Montes-Moreno S, Martinez N, Sanchez-Espiridión B, et al. Expression de miRNA dans le lymphome diffus à grandes cellules B traité par chimio-immunothérapie. Sang . 2011;118(4):1034-1040. doi: 10.1182/blood-2010-11-321554
Implication possible de l'interaction CCL1-CCR8 dans le recrutement lymphocytaire dans la cholangite sclérosante liée aux IgG4 - Journal of Hepatology. Consulté le 8 octobre 2024. https://www.journal-of-hepatology.eu/article/S0168-8278(13)00432-7/abstract
Seeley JJ, Baker R, Mohamed G, et al. Induction de la mémoire immunitaire innée via le ciblage par microARN des facteurs de remodelage de la chromatine. Nature . 2018;559(7712):114-119. doi: 10.1038/s41586-018-0253-5
Saito M, Shimura T, Hashimoto Y, et al. Cholangite sclérosante intrahépatique liée à l'IgG4 entraînant une septicémie causée par une inflammation suppurée secondaire : rapport d'un cas. Surg Today . 2013;43(10):1175-1179. doi: 10.1007/s00595-012-0448-6
Hanif N, Anwer F. Rituximab. Dans : StatPearls . StatPearls Publishing ; 2024. Consulté le 8 octobre 2024. http://www.ncbi.nlm.nih.gov/books/NBK564374/
Yamamoto M. Thérapie ciblée par les cellules B pour les maladies liées aux immunoglobulines G4. Médecine immunologique . 2021;44(4):216-222. doi: 10.1080/25785826.2021.1886630








Commentaires
Enregistrer un commentaire