Vaccin C19- Une arme biologique de mauvaise qualité
De : https://sashalatypova.substack.com/p/broken-bioweapon?
Manque d'intégrité de l'ARNm dans les lots de Pfizer : tous les régulateurs le savaient lorsqu'ils ont
"fait semblant d'approuver" les injections
Contexte :
Un manque d'intégrité de l'ARNm et des impuretés du produit (chaînes d'acide nucléique fragmentées) ont été trouvés dans le produit de Pfizer quelques jours avant son autorisation de mise sur le marché. L'intégrité de l'ARNm, et inversement, son instabilité, est l'une des variables les plus importantes concernant tous les vaccins à ARNm. Pfizer et BioNTech ont déclaré à plusieurs reprises que l'efficacité du produit dépend fortement de la quantité de la molécule d'ARNm suffisamment intacte. Même une réaction de dégradation mineure, n'importe où le long d'un brin d'ARNm, peut gravement ralentir ou arrêter les performances de traduction appropriées de ce brin et ainsi entraîner l'expression incomplète de l'antigène cible.
Une variation extrêmement large de l'intégrité de la substance active dans le matériau en vrac du produit et la présence abondante d'impuretés d'acide nucléique non caractérisées signifie que des lots de formulation différente - et donc avec différents profils de puissance et de sécurité - ont été produits. Cette variation est encore amplifiée lorsque des centaines de litres de matériel en vrac sont remplis en petites quantités dans des flacons de 0,45 ml et ensuite divisés manuellement en doses par du personnel non formé et non supervisé dans les centres de vaccination.
À ce jour, les régulateurs et Pfizer n'ont pas divulgué les plages acceptables ou les méthodes de test pour les ingrédients clés du produit vaccinal, ni dans le produit en vrac, ni dans un flacon ou une dose (telle que distribuée), et prétendent que les « secrets commerciaux » les en empêchent .
33 lots commerciaux fabriqués avant décembre 2020 :
les archives publiées par la fuite de l'EMA contiennent des détails de fabrication et de test pour 33 lots à l'échelle commerciale fabriqués par Pfizer entre août et fin novembre 2020. Le fait que des lots commerciaux aient été fabriqués avant l'examen réglementaire et avant toute donnée d'innocuité ou d'efficacité disponible pour le produit est une violation du CFR21 - les Bonnes Pratiques de Fabrication en vigueur. Pour clarifier, une entreprise peut fabriquer un volume de produit avant l'approbation, mais une fois que l'examen réglementaire trouve des problèmes importants dans la soumission (comme cela a été trouvé ici) - expédier ces lots commercialement sans démontrer que les problèmes trouvés n'affectent pas la sécurité du produit et l'efficacité est un gros problème. Compte tenu du nombre d'objections importantes et majeures et du court laps de temps (environ 2 semaines avant l'expédition du produit), il n'est pas possible que ces problèmes aient été résolus.
C'est pourquoi aucun fabricant sain d'esprit et bien intentionné ne ferait jamais une telle chose - produire des millions de doses d'un produit coûteux "à risque" avant de déterminer s'il est réellement sûr. Cependant, les génies de BARDA pensent que c'est branché, cool et "innovant" et que seuls les perdants du secteur privé devraient respecter les lois et réglementations. Lorsque le gouvernement s'occupe de « sauver des vies », aucune loi ne s'applique et personne ne se soucie des réglementations ennuyeuses :
Retour sur les 33 lots avec « pré-autorisation » :
Plus précisément, ces lots et toutes les informations utilisées dans mon analyse ont été répertoriés dans le document intitulé : "COVID-19 Vaccine (BNT162, PF-07302048) BB-IND 19736 Response to CBER Comments Received on 20 November 2020 Concerning Overall CMC Information". Le document est daté du 25 novembre 2020. Il faisait partie des documents qui ont été divulgués par l'EMA. Voici la page de titre :
Au moment de la publication de ce document, les installations de fabrication ont été jugées non conformes aux bonnes pratiques de fabrication actuelles par les autorités réglementaires (EMA et FDA) CGMP un ensemble d'exigences réglementaires guidant la qualité, la pureté, la stabilité et la reproductibilité et l'étiquetage des médicaments et vaccins produits en masse. Les réglementations cGMP pour les médicaments contiennent des exigences minimales pour les méthodes, les installations et les contrôles utilisés dans la fabrication, la transformation et l'emballage d'un produit pharmaceutique. La réglementation garantit qu'un produit peut être utilisé sans danger et qu'il contient les ingrédients et la force qu'il prétend avoir.
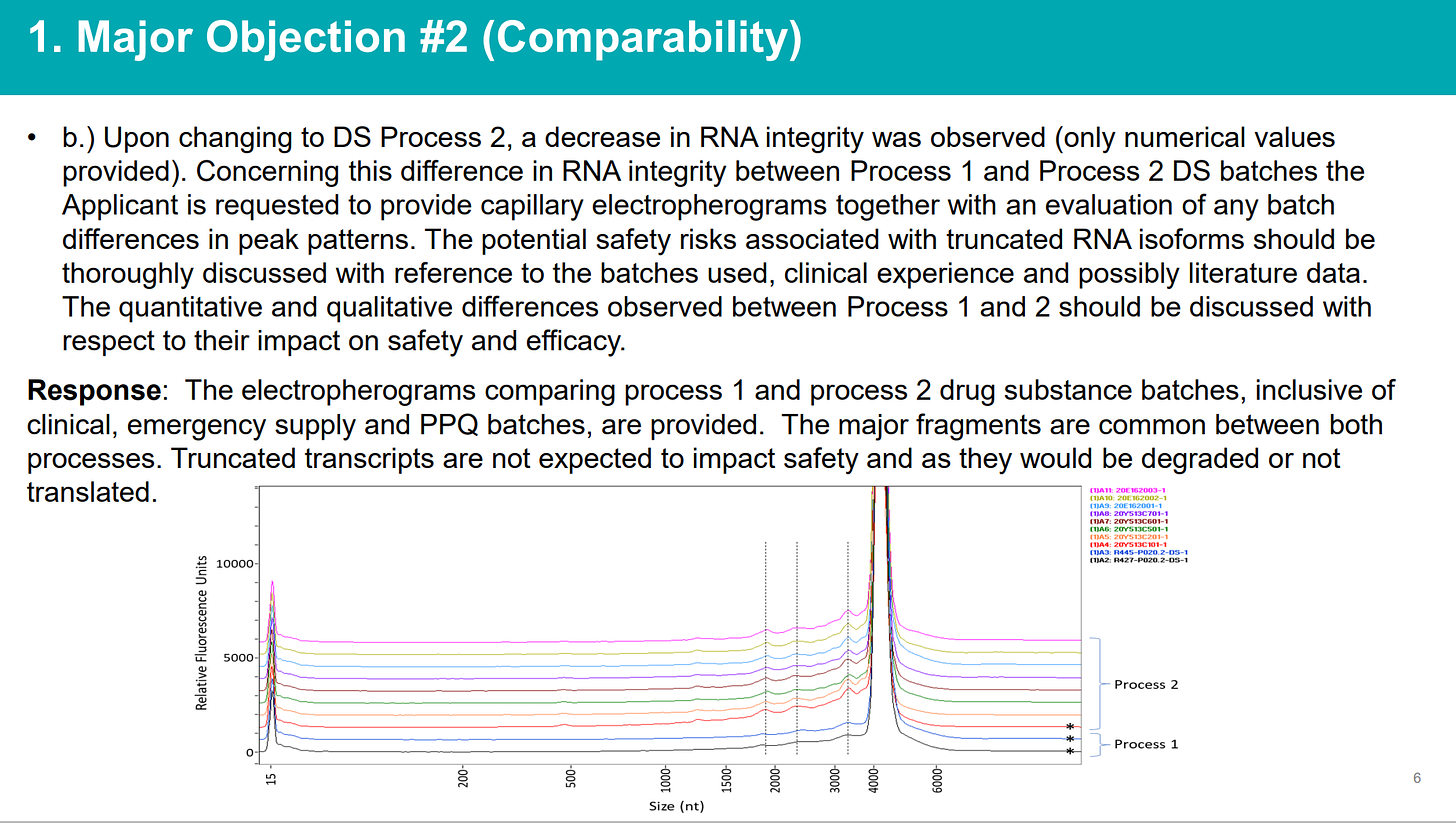
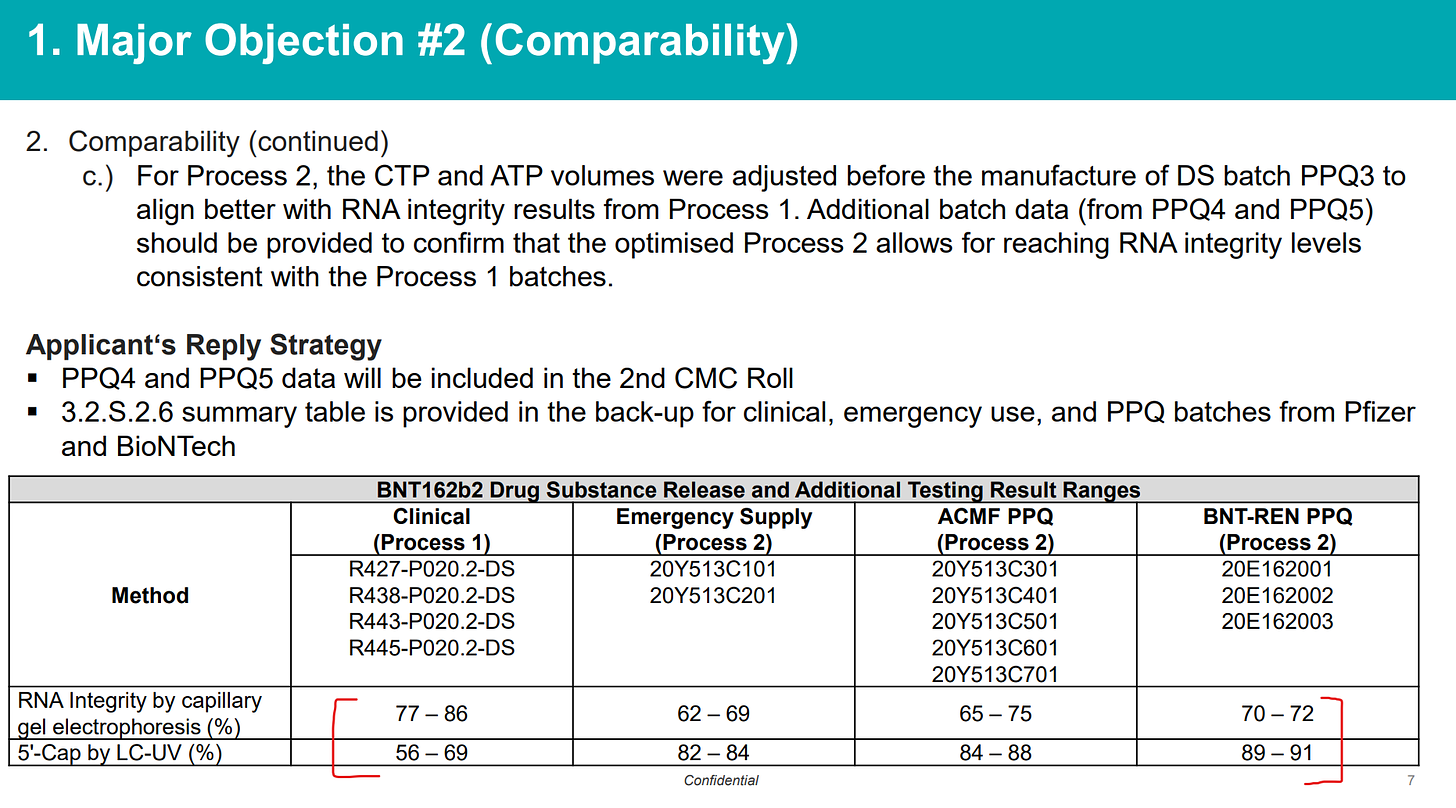
La non-conformité aux cGMP a été enregistrée en tant qu'objection majeure n ° 1 par les examinateurs de l'EMA, et en outre, le problème du manque d'intégrité de l'ARNm et de la présence d'importantes impuretés non caractérisées sous la forme de chaînes d'acides nucléiques (LMS) a été soulevé et enregistré comme Objection majeure #2. Voici les diapositives de la réunion EMA-BioNTech traitant de la question de la «comparabilité», c'est-à-dire que les lots utilisés pour fabriquer le matériel d'essai clinique (en utilisant le processus 1) étaient très sensiblement différents des lots fabriqués à l'échelle commerciale (processus 2) et il n'y avait pas moyen de concilier cela sans refaire un essai clinique. Mais bien sûr, ce n'est pas ce qu'ils ont décidé de faire. La réponse consistait simplement à abaisser la norme d'acceptation, qui avait été arbitrairement fixée au départ, de > 70 % à >
Les régulateurs et le fabricant savaient qu'il y aurait des molécules "tronquées", et n'avaient aucune idée des protéines mutantes que cela créerait...
Ils avaient des tests montrant des différences de profil significatives entre les lots du processus 1 et du processus 2 (notez les «bosses» avant le pic principal)…
L' % d'intégrité de l'ARNm n'était pas comparable entre le processus 1 et le processus 2 (ni à proprement parler, au sein de chaque processus )…
La «stratégie de réponse du demandeur» consistait simplement à abaisser le seuil d'acceptation sans aucune donnée montrant que tout cela était correct…
Il était clair que l'ARNm se cassait et se dégradait pendant la production (substance médicamenteuse transformée en produit médicamenteux), et par la suite pendant le stockage en rayon. Bien sûr, ce processus se poursuit pendant le transport et la préparation manuelle des doses, car ceux qui « se déplacent à la vitesse de $ience ! (TM) » ne sont concernés par aucun de ces trucs de piétons…
Pour résumer, dans son examen continu de novembre 2020, l'EMA a noté qu'une diminution de l'intégrité de l'ARN, qui est un attribut de qualité critique, a été observée de sorte que l'intégrité de l'ARN du processus 1 (78,1-82,8 %) était bien supérieure à celle à l'échelle commerciale. processus 2 (59,7 %). De plus, il n'a pas été possible de déterminer si les différences d'intégrité de l'ARN étaient qualitatives, quantitatives ou les deux. Les ARNm tronqués dans le processus 2 n'étaient pas non plus définis. Au moment de l'autorisation de mise sur le marché conditionnelle dans l'UE, on ne savait pas pour quelles protéines étaient codées, le cas échéant, et leur effet clinique n'était pas connu. Il ne pouvait pas être exclu que des protéines différentes de la pointe pleine longueur intacte soient exprimées. Il est également possible que l'ARNm tronqué affecte l'efficacité de la traduction ou modifie le profil immunostimulateur.
Il y a eu de nombreuses objections et préoccupations supplémentaires de la part du régulateur (plus de 100 objections réglementaires formelles ont été trouvées dans les documents de l'EMA à partir de fin novembre 2020).
Les 33 lots de Pfizer contenaient un total d'environ 6 millions de flacons pour environ 29 millions de doses de vaccin. Notez qu'au moment de l'approbation, les flacons multidoses de Pfizer étaient pour 5 doses contre 6 spécifiées sur l'étiquette aujourd'hui. Ces lots ont été expédiés commercialement vers des sites aux États-Unis et en Europe (et éventuellement dans d'autres régions) malgré la fabrication non conforme documentée ou de graves préoccupations réglementaires. Sur ces 33 lots, 26 lots sont associés à des rapports d'événements indésirables dans la base de données VAERS.
Le tableau ci-dessous fournit quelques détails sur ces lots ainsi que le nombre d'événements indésirables et de décès trouvés dans le VAERS. Il convient de noter qu'étant donné que ces lots ont été distribués dans de nombreuses régions, y compris aux États-Unis, en Europe et dans d'autres endroits, des parties des lots ou des lots entiers peuvent avoir été envoyés à des endroits qui n'ont pas soumis de rapports d'événements indésirables au système VAERS. De plus, le système VAERS est connu pour sous-représenter le véritable taux d'événements indésirables de 40 à 100 fois. Par conséquent, le taux réel d'événements indésirables associés à ces lots est susceptible d'être plusieurs fois supérieur à ce qui est indiqué ici.
Enfin, tous ces lots ci-dessous ont une date d'expiration indiquée au 31/12/2069 (!) - un pur non-sens.
Tableau 1.
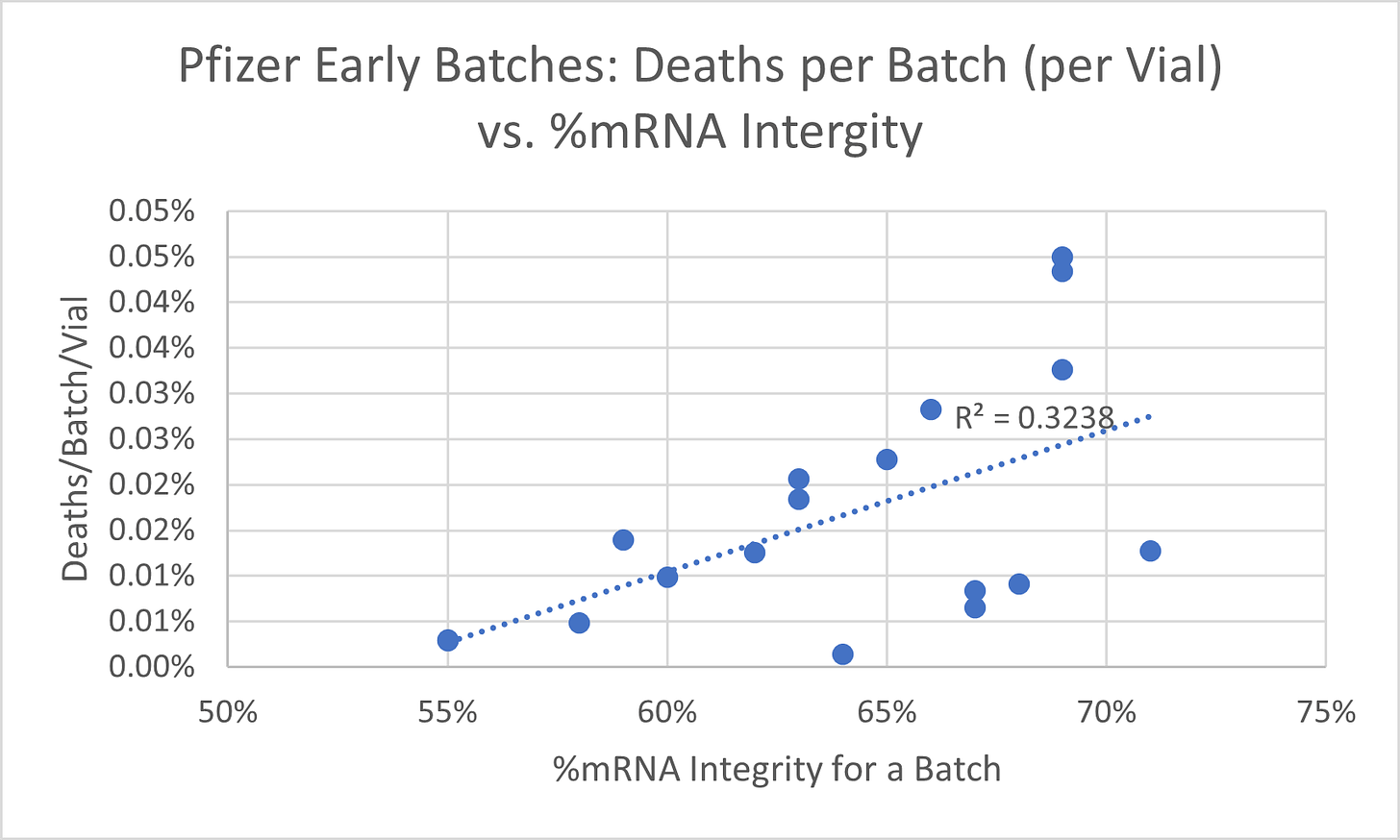
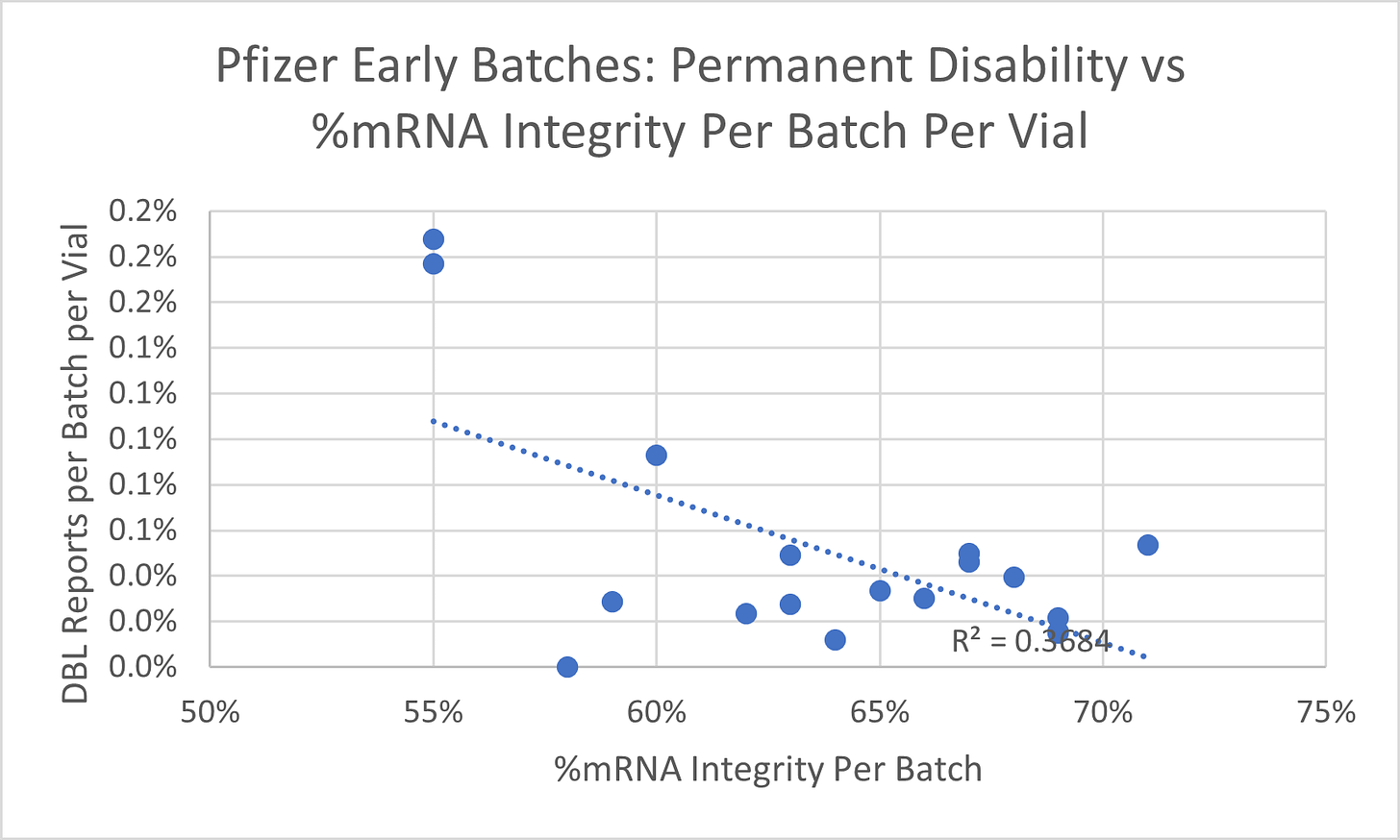
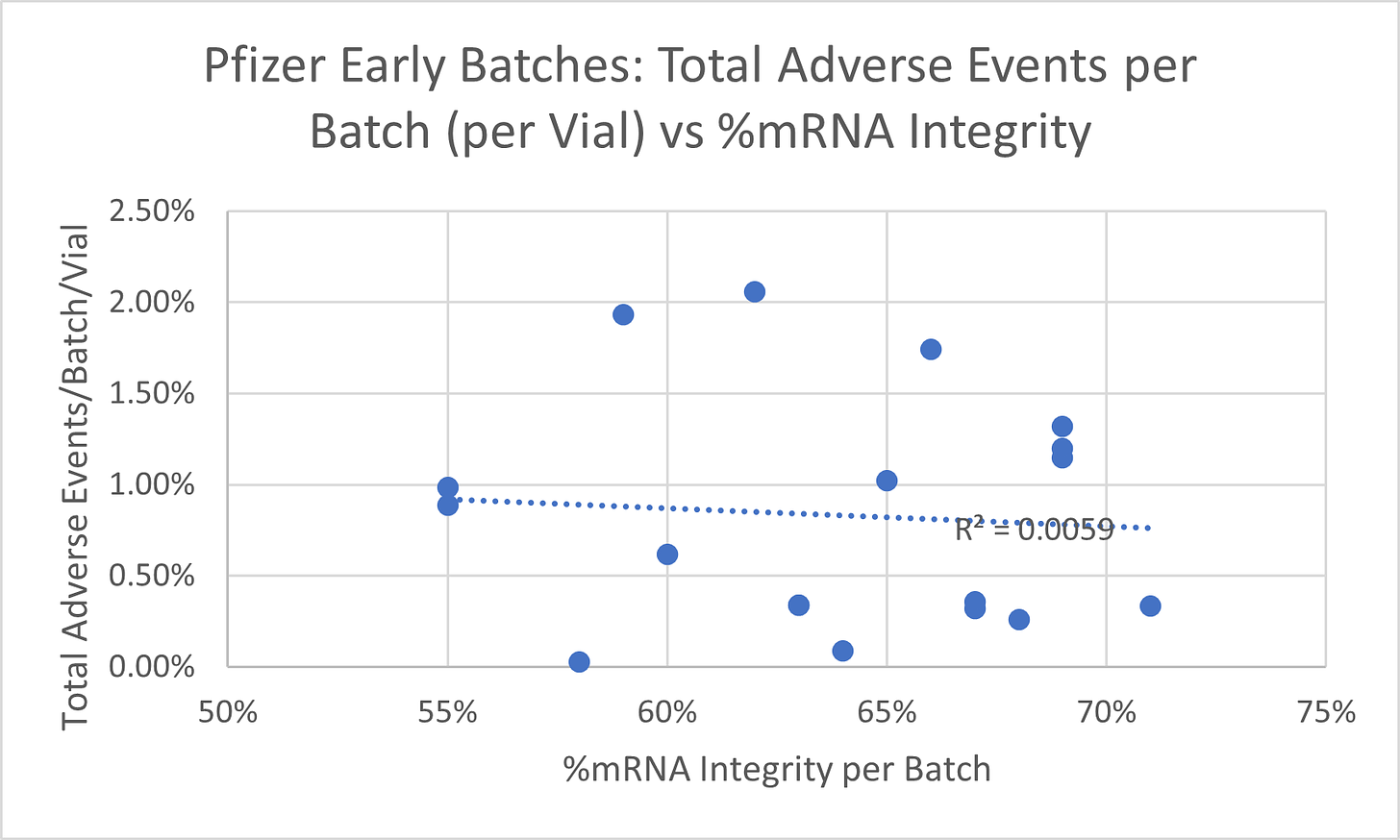
Les documents de l'EMA et de la FDA contenaient des analyses de lots détaillées pour 18 lots, y compris la métrique d'intégrité ARNm. J'ai comparé ce paramètre aux décès, aux incapacités permanentes et au nombre total d'événements indésirables (y compris non graves) signalés pour le numéro de lot dans la base de données de notification des événements indésirables des vaccins du CDC (VAERS). L'analyse de régression a démontré une relation statistique significative entre le pourcentage d'intégrité de l'ARNm et les décès et les incapacités permanentes signalés par lot. Les décès, les incapacités et les taux d'effets indésirables totaux ont été ajustés en fonction du nombre de flacons produits dans un lot. Seule une légère relation inverse a été trouvée pour le nombre total d'événements indésirables qui comprenaient des événements non graves. Les figures 1 à 3 résument les résultats.
Figure 1.
La figure 1 montre une pente positive significative (R2 = 0,33) entre le % d'intégrité de l'ARNm et la mort signalée par lot, ajustée en fonction du nombre de flacons produits - une intégrité plus élevée dans les premiers lots conduit à des événements plus mortels signalés pour le lot dans VAERS. Cela indique qu'au moins ce groupe de lots était un produit mortel (causant la mort) lorsqu'il était fabriqué conformément à la spécification.
Figure 2.
La figure 2 montre l'association inverse significative (R2 = 0,37) entre l'intégrité de l'ARNm en % et les incapacités permanentes signalées par lot, ajustées en fonction du nombre de flacons produits - une intégrité plus élevée dans les premiers lots entraîne relativement moins d'événements d'invalidité permanente signalés pour le lot dans VAERS . Il est possible que le produit mortel n'ait pas été aussi puissant dans certains des flacons d'un lot et qu'il n'ait tué que des personnes handicapées. Il est également possible qu'il ait tué des personnes plus âgées / plus fragiles et des personnes handicapées plus jeunes (cela n'a pas été spécifiquement testé dans mon analyse).
Figure 3.
La figure 3 montre que seule une légère tendance inverse a été trouvée lorsque le nombre total d'événements indésirables signalés par lot par rapport à la métrique d'intégrité de l'ARNm est examiné. Le total comprend tous les rapports et décès graves et non graves ensemble.
Discussion:
Au moment de l'autorisation de mise sur le marché conditionnelle dans l'UE, il semble que le produit de Pfizer ne réponde normalement pas aux contrôles de qualité les plus élémentaires attendus d'un produit pharmaceutique injectable. La pharmacologie de base était inconnue, la quantité de pointe produite était inconnue, et la qualité et la reproductibilité de la production des lots commerciaux étaient extrêmement médiocres.
Mon ensemble de données présente des tendances alarmantes - des gammes extrêmement larges d'événements indésirables, de décès et d'invalidités, ainsi qu'une forte association statistique entre la mesure d'intégrité de l'ARNm et les décès/invalidités permanentes. L'intégrité de l'ARNm n'est que l'une des dizaines d'attributs de qualité critiques de ce produit. Le fabricant n'a jamais mis les lots à disposition pour un test indépendant et une caractérisation, un séquençage ou une évaluation de l'ARNm ou d'autres fragments d'acide nucléique et des impuretés qu'ils contiennent.
Ainsi, des millions de personnes injectées avec ces substances ne peuvent jamais savoir quelle(s) séquence(s) exacte(s) d'acides nucléiques étaient présentes dans ces injections, et quelles protéines peuvent être exprimées et quel impact sur la santé elles peuvent avoir. Malheureusement, au moins 1000 personnes ont perdu la vie à cause de ces effets "inconnus" d'un produit mal fabriqué enveloppé de "secret commercial".
Le produit Pfizer ne répond pas aux exigences de qualité rigoureuses d'un produit de qualité pharmaceutique donné à des milliards d'humains et contient de grandes quantités d'impuretés. Le fabricant et les régulateurs évitent activement la transparence, la divulgation ou la correction de ces problèmes. Ces actes ne peuvent plus être considérés comme des "erreurs" dans des conditions "précipitées". Les produits doivent être arrêtés et rappelés dans le monde entier et des enquêtes approfondies doivent être lancées.
Œuvre d'art d'aujourd'hui : Tournesol, huile sur panneau, 18x24 pouces.









Commentaires
Enregistrer un commentaire